Общие сведения о горении
Горение – физико-химический процесс взаимодействия горючего вещества и окислителя, характеризующийся самоускоряющимся превращением и сопровождающийся выделением большого количества тепла и света.
В качестве окислителя - кислород воздуха, которого содержится около 21%.
Для возникновения и развития процесса горения необходимы горючее вещество, окислитель и источник воспламенения. Этот источник должен обладать определенным запасом энергии и иметь температуру, достаточную для начала реакции.
Горючее и окислитель должны находиться в определенных соотношениях друг с другом. Горение, как правило, происходит в газовой фазе. Поэтому горючие вещества, находящиеся в конденсированном состоянии (жидкости, твердые материалы), для возникновения и поддержания горения должны подвергаться газификации (испарению, разложению), в результате которой образуются горючие пары и газы в количестве, достаточном для горения.
Горение отличается многообразием видов и особенностей, обуславливаемыми процессами тепломассообмена, газодинамическими эффектами, кинетикой химических превращений и др., а также обратной связью между внешними условиями и характером развития горения.
В зависимости от агрегатного состояния горючих веществ горение может быть гомогенным и гетерогенным.
При гомогенном горении компоненты горючей смеси находятся в газообразном состоянии. Причем, если компоненты перемешаны, то происходит горение предварительно перемешанной смеси, которое иногда называют кинетическим (скорость горения зависит только от кинетики химических превращений).
Если газообразные компоненты не перемешаны, то происходит диффузионное горение (например, при поступлении горючих паров в воздух от поверхности горючей жидкости или при горении стеариновой свечи).
Горение, характеризуемое наличием раздела фаз в горючей системе (например, горение твердых материалов), является гетерогенным. При гетерогенном горении большое значение приобретают также процессы, ведущие к изменению фазового состояния. Для поддержания гетерогенного горения важную роль играет также интенсивность потока образуемых из конденсированных материалов горючих паров.
В заранее подготовленных смесях (смесь горючего и окислителя) горение происходит в виде распространения фронта пламени по этой смеси от источника зажигания. Такое горение различается по скорости распространения пламени, и в зависимости от этого фактора оно может быть дефляграционным (скорость пламени в пределах нескольких м/с), взрывным (скорость пламени до сотен м/с) и детонационным (скорость порядка тысяч м/с). Детонационное горения происходит в твердых взрывчатых веществах и сопровождается образованием ударной волны.
Кроме того, различают ламинарное горение, характеризуемое послойным распространением фронта пламени по свежей горючей смеси, и турбулентное горение, характеризуемое перемешиванием слоев потока и повышенной скоростью выгорания.
Можно выделить бедные (содержащие в избытке по сравнению со стехиометрическим соотношением компонентов окислитель) и богатые (содержащие в избытке горючее) горючие смеси.
Стехиометрическим называется исходное соотношение компонентов горючей смеси, при сгорании которой ни один из исходных компонентов не остается в избытке в продуктах реакции.
Например, для реакции сгорания метана в воздухе (в котором на один 1 объем кислорода приходится 3,78 объемов азота) стехиометрическое соотношение компонентов составляет:
1СН4 + 202 + 2 • 3,78N2 = СО2 + 2Н2О + 7,56N2
Согласно этому уравнению стехиометрическое содержание метана составляет:

Расчет стехиометрического содержания горючего вещества для наиболее распространенного класса горючих веществ - углеводородов и их производится по формуле:
 где
где 
здесь nc, nн, no - соответственно число атомовС, Н, О в молекуле горючего.
Реальные пожары характеризуются, как правило, диффузионным гетерогенным турбулентным и дефляграционньм горением.
Взрывное горение может иметь место в предварительно приготовленных смесях горючих газов и паров с воздухом (например, при утечке горючего газа из трубопровода или испарении пролитой горючей жидкости), а также в жидких и твердых горючих аэрозолях (взвешенные в воздухе капли горючих жидкостей или горючие пыли).
Горение может осуществляться в двух режимах: самовоспламенения, заключающемся в самопроизвольном возникновении пламенного горения предварительно нагретой до некоторой критической температуры горючей смеси (называемой температурой самовоспламенения) и проявляющегося в одновременном (в виде вспышки) сгорании всей горючей смеси, и в режиме распространения волны горения (распространения фронта пламени) по холодной смеси при ее локальном зажигании (воспламенении) внешним источником.
Пламя - это видимая зона горения, в которой наблюдаются свечение и излучение тепла. Возникшее в результате воспламенения пламя само становится источником потока тепла и химически активных частиц в прилегающие слои свежей горючей смеси, за счет чего обеспечивается перемещение фронта пламени.
Для получения представлений о распространении волны горения поместим гомогенную горючую смесь в стеклянную трубку, открытую с одного конца (рис. 1.1), и воспламеним ее внешним источником у открытого конца.
1
 Продукты сгорания
2 Продукты сгорания
2
| 3 Свежая смесь |
Схема распространения пламени в гомогенной газовой смеси:
1 - стеклянная трубка, 2 - фронт пламени, 3 - направление распространения пламени
Распространяющееся вначале сферически пламя при достижении стенок трубки преобразуется в плоский узкий (толщиной менее 10-6 м) фронт, распространяющийся в сторону свежей смеси. Продукты сгорания, объем которых в результате повышения температуры в несколько раз превышает объем исходной смеси, истекает из трубки через открытый конец. Скорость перемещения фронта пламени по нормали к его поверхности называется нормальной скоростью распространения пламени и обозначается Uн. Нормальная скорость пламени имеет минимально возможную величину, не зависит от условий, а лишь от химического состава горючей смеси и соотношения горючего и окислителя (максимальное значение Uн соответствует стехиометрическому соотношению компонентов горючей смеси). Этот показатель, строго говоря, является единственным из всех многочисленных характеристик пламени, имеющим характер физико-химической константы.
Если же закрыть свободный конец трубки, то горячие продукты сгорания как поршень будут давить на пламя и увеличивать скорость его перемещения. Суммарная скорость такого перемещения фронта пламени называется видимой скоростью пламени (обозначается Uв) и определяется выражением: Uв = Uн e где e - степень расширения продуктов сгорания: 
h - отношение числа молей продуктов сгорания к числу молей исходной смеси, Тг, То - температура горения и начальная температура. Величина h для углеводородных горючих веществ близка к единице.

Рис. 1.2. Схема диффузионного ламинарного пламени:
а - зона горючих паров, б - зона горения, в - окружающая среда (воздух).
В случае диффузионного горения, схема которого показана на рис. 1.2, пламя как бы стоит на месте, а в него втекают с одной стороны (область "а") горючие пары, а с другой стороны (область "в") - воздух. Наиболее характерным примером диффузионного пламени является горящая свеча.
Важнейшей особенностью процесса горения является самоускоряющийся характер химического превращения. В соответствии с представлениями о кинетике химических реакций скорость реакции описывается уравнением Аррениуса:
W = A [Г]a [O]в exp(-E/RT) (1.3)
где [ Г ] и [ О ] - соответственно концентрации горючего и окислителя;
А - предэкспонента;
а, в - стехиометрические коэффициенты, с которыми участвуют в реакции компоненты горючей смеси;
Е - энергия активации, требуемая для такого ослабления внутримолекулярных связей, чтобы началась реакция;
Т - температура;
R - газовая постоянная.
Два механизма самоускоряющихся превращений при горении, теории которых разработаны лауреатом Нобелевской премии Н.Н.Семеновым и его учениками, - тепловой и цепной.
Тепловой механизм заключается в возрастании W с увеличением Т, а увеличение Т обусловлено экзотермичностью реакции окисления-восстановления. Согласно теории "теплового взрыва" разогрев в горючей смеси при ее последовательном нагреве извне обусловливается соотношением скоростей процессов тепловыделения (dq1/dt) и теплоотвода из зоны реакции (dq2/dt) и возникает тогда, когда достигается условие:
dq1/dt > dq2/dt (1.4)
Поскольку = dq1/dt = Q•W (Q - тепловой эффект реакции, W - скорость реакции) изменяется согласно уравнению (1.3) с температурой экспоненциально, а
dq2/dt = a S/V (Т-То)
(где a - коэффициент теплоотдачи в стенки реакционного сосуда; S - поверхность сосуда; V - объем сосуда; Т, То - температура текущая и начальная) изменяется с температурой линейно, то с повышением температуры интенсивность тепловыделения начинает обгонять интенсивность теплоотвода. Поэтому при непрерывном нагреве горючей смеси обязательно должно достигаться условие, определяемое неравенством (1.4). Наинизшая температура, при которой достигается это условие, и есть температура самовоспламенения. Поскольку в (1.4) содержатся характеристики сосуда, т.е. конкретные условия процесса, то представляется понятным, почему температура самовоспламенения не является постоянной, а зависит от конкретных условий проведения процесса самовоспламенения.
Ускорить реакцию можно не только за счет повышения температуры при саморазогреве в ходе экзотермической реакции, но и в результате особого типа химических превращений при горении - цепных разветвленных реакций. Эти реакции происходят за счет особых активных частиц - радикалов и свободных атомов, обладающих свободными валентными связями. При столкновении этих частиц с исходными молекулами или продуктами превращения взаимодействие между ними протекает при значительно меньших величинах энергии активации, чем при молекулярных процессах. Причем, в ходе протекания цепных реакций особого рода - разветвленных - скорость реакции может бурно расти за счет того, что в результате взаимодействия активного центра с молекулой образуется несколько активных центров. От дополнительно созданных активных частиц начинаются собственные цепи превращений, что приводит к еще большему накоплению активных центров и лавинообразному нарастанию скорости суммарного процесса. Однако, наряду с разветвлением цепного процесса происходят реакции, ведущие к гибели активных центров или к обрыву цепей. Окончательный результат зависит от соотношения скоростей реакций разветвления и обрыва цепей, характеризуемого выражением:
Типичным примером разветвленной цепной реакции является окисление водорода при горении водорода, описываемое следующей схемой:
Н2 + О2 ® 2ОН - зарождение цепи,
ОН + Н2 ® Н2О + Н - продолжение цепи,
Н+О2 ® ОН + О - разветвление цепи,
О + Н2 ® ОН + Н - разветвление цепи,
Н + Н + стенка ® Н2 - гетерогенный обрыв цепи на стенке сосуда,
Н + О2 + М ® Н2О + М - гомогенный обрыв цепи в объеме смеси с участием молекулярной частицы М.
Из этой схемы видно, что за один цикл превращений каждый вступающий в реакцию атом водорода приводит к образованию трех новых активных частиц. Теория цепных реакций позволила объяснить многие особенности процессов горения: сильное влияние некоторых примесей, существование пределов самовоспламенения по давлению, катализ и ингибирование горения и др.
Механизм возникновения и развитие реальных пожаров и взрывов характеризуется комбинированным цепочечно-тепловым процессом. Начавшись цепным путем, реакция окисления за счет ее экзотермичности продолжает ускоряться за счет тепла. В конечном счете, критические (предельные) условия возникновения и развития горения будут определяться тепло выделением и условиями тепломассообмена реагирующей системы с окружающей средой.
Как и при самовоспламенении, горение в режиме распространения пламени обуславливается цепочечно-тепловым механизмом. Распространение пламени происходит путем переноса из фронта пламени в свежую горючую смесь потоков тепла молекулярной теплопроводностью и активных центров диффузией. Соотношение между этими потоками зависит от химической природы горючей смеси, развиваемой во фронте пламени температуры и условий распространения пламени. Для обычных горючих веществ и материалов (органических, т.е. на основе углеводородов и их производных), нижняя температурная граница пламени которых составляет около 1300К, а максимальная температура горения может достигать 2500К, доминирующее значение приобретает перенос тепла.
Тепловая теория, разработанная Я.Б.Зельдовичем, исходит из подобия полей концентраций и температур во фронте пламени и выражается следующей зависимостью, связывающей скорость пламени с переносом энергии и со скоростью превращения:
Из этой теории следует, что
Uн» Pn/2-1 (1.5)
где р - давление, n - порядок реакции (сумма стехиометрических коэффициентов в уравнении 1.3).
Многочисленные опытные данные свидетельствуют, что скорость пламени углеводородо-воздушных смесей с давлением уменьшается по закону:
Uн» P-0.2¸0.5 (1.6)
Сопоставляя это выражение с уравнением (1.5) можно видеть, что порядок реакции при горении таких смесей имеет дробную величину. Это свидетельствует о сложном немолекулярном механизме химических превращений в пламени.
Пожаро- и взрывоопасность веществ и материалов
Пожарная и взрывная опасность веществ и материалов - близкие характеристики. Различие между характеристиками заключается в скорости распространения пламени, которая для взрывных процессов существенно выше, чем при пожаре. Способностью к взрывному горению обладают смеси с воздухом горючих газов и паров горючих жидкостей, а также взвеси в воздухе (аэрозоли) горючих пылей и капель горючих жидкостей.
Знание скорости распространения пламени необходимо для оценки возможной взрывной нагрузки на здания и сооружения в том случае, когда внутри или снаружи здания может образовываться взрывоопасная газо-, паро- или пылевоздушная среда, а также для расчета и проектирования предохранительных конструкций, предназначенных для сброса избыточного давления, развиваемого при взрывном сгорании, и предохранения здания от разрушения.
Фактическая скорость распространения пламени не является постоянной и зависит от многих факторов. Важно то, что сгорание взрывоопасной смеси может протекать с ускорением. А чем выше скорость распространения пламени, тем более опасно взрывное горение.
Многочисленными исследованиями было показано, что вероятность детонационного сгорания реально создаваемых взрывоопасных сред весьма мала, а возможность взрывного горения, сопровождающегося ударной волной, представляющую собой распространяющуюся волну скачка уплотнения газа, создается при эффективной видимой скорости пламени, равной примерно 0,2 М (М - число Маха, определяемое отношением фактической скорости перемещения газа к скорости звука в данной среде). Для углеводородовоздушных смесей это соответствует видимой скорости пламени около 60 м/с.
Причинами ускорения пламени (интенсификации горения) могут быть различные газодинамические и теплофизические явления.
Пожаро- и взрывоопасность веществ и материалов определяется показателями, характеризующими предельные условия возникновения горения и максимальную опасность, создаваемую при возникшем горении. При этом необходимо помнить, что собственно сгорание веществ и материалов, как правило, происходит в газовой фазе. Поэтому характер показателей и их количество зависят от агрегатного состояния горючих материалов.
Когда горючим веществом является газ, основными показателями являются:
КПР - концентрационные пределы распространения пламени, называемые также пределами воспламенения или взрываемости,
Uн (м/с) - нормальная скорость распространения пламени,
Тс (оС) - температура самовоспламенения,
МЭЗ (Дж) - минимальная энергия зажигания,
Pmax (кПа) - максимальное давление, возникающее в помещении при быстром расширении нагретых продуктов сгорания, которое может разрушить помещение. Внешне это явление выглядит как взрыв.
Производными от них являются:
dP/dt (мПа/с) - скорость нарастания давления взрыва,
МВСК (% об.) - минимальное взрывоопасное содержание кислорода.
Физический смысл КПР может быть пояснен следующим образом. Представляется очевидным, что при последовательном повышении содержания компонентов горючей смеси от их нулевого значения до некоторой их вполне определенной концентрации будет достигаться условие, характеризуемое уравнением (1.4), и возникнет пламя, распространяющееся с соответствующей Uн. Предел, определяемый минимальным содержанием горючего компонента в бедной смеси, называется нижним концентрационным пределом распространения пламени (НКПР), а предел, лимитируемый содержанием окислителя в богатой смеси и характеризуемый максимально возможным содержанием горючего компонента, при котором еще возможно распространение пламени, называется верхним концентрационным пределом распространения пламени (ВКПР).
Для наглядности на рис. 1.3 КПР показанаСхема концентрации пределов распространения пламени.
     
| Область воспламенения | |||
 0% горючего 0% горючего
| 100% горючего | |||
| 100% воздуха | НКПР | ВКПР | 0% воздуха | |
| Стехиометрическое соотношение горючего и воздуха | ||||
Горение возможно в области составов между НКПР и ВКПР, называемой областью воспламенения. Вне этой области горение в режиме распространения пламени невозможно.
МЭЗ - наименьшая энергия искры электрического разряда, достаточная для зажигания наиболее легковоспламеняемой (обычно стехиометрической) смеси данного горючего вещества с воздухом.
Рmax - максимальное давление, развиваемое при воспламенении (зажигании) стехиометрической смеси данного горючего вещества.
dP/dt - скорость нарастания давления взрыва, зависящая от состава горючей смеси; различают максимальную и среднюю скорости нарастания давления.
МВСК - это предельное содержание кислорода в горючей смеси, разбавленной не участвующим в горении газом (инертным разбавителем или избыточным компонентом горючей смеси). МВСК определяют путем построения кривых, флегматизации, ограничивающих область воспламенения. На рис. 1.4 показан типичный график флегматизации, на котором на оси ординат показано содержание горючего компонента, на оси абсцисс - концентрация разбавителя (флегматизатора).

График флегматизации Сф (флегматизатор)
Горение возможно внутри области, ограниченной кривой флегматизации.
Содержание воздуха в каждой точке кривой флегматизации определяется выражением
Св = 100 - (Сг + Сф)
где Св, Сг, Сф - концентрации воздуха, горючего и флегматизатора соответственно, % об.
Минимальное содержание кислорода, при котором еще может гореть разбавленная горючая смесь, соответствует мысу кривой флегматизации. Обычно МВСК определяют при флегматизации горючих смесей азотом, диоксидом углерода.
Горение осуществляется в газовой фазе, поэтому оценка пожароопасности конденсированных веществ должна дополняться показателями, характеризующими условия образования газообразной горючей смеси. При этом важнейшим является показатель, определяющий достаточную для поддержания распространения пламени интенсивность поступления в зону горения потока горючих паров.
При оценке пожароопасности жидкостей перечисленные выше показатели дополняются следующими:
Твсп - температура вспышки, С;
Тв - температура воспламенения, С;
ТП - температурные пределы воспламенения (нижний - НТП, верхний - ВТП), С.
Твсп - минимальная пожароопасная температура жидкости, при которой внесенный извне в паровое пространство над жидкостью источник зажигания вызывает быстрое сгорание паров, но при удалении источника зажигания горение прекращается. По физическому смыслу Твсп минимальная температура жидкости, при которой давление насыщенных паров жидкости создает концентрацию паров над жидкостью, соответствующую НКПР. В зависимости от летучести жидкости, характеризуемой температурой вспышки и позволяющей судить о возможности образования взрывоопасной среды, жидкости подразделяются на легковоспламеняющиеся (ЛВЖ) и горючие (ГЖ). К ЛВЖ относятся жидкости с Твсп <= 61°С и к ГЖ - с Твсп > 61°С.
Расчет Твсп (формула Элея)
Твсп = Ткип - 18ÖК, где Ткип - температура кипения С,
К = 4nc + nH +4nS + nN2 – 2nO2 (nc, nH, nS, nN2, nO2 – число атомов углерода, водорода, серы, азота и кислорода в молекуле исследуемой жидкости).
Свойства наиболее распространенных веществ и материалов приведены в Справочнике "Пожаровзрывоопасность веществ и материалов и средства их тушения" под ред. Баратова А.Н. и Корольченко А.Я., М., 1990.
Для устойчивого горения жидкости недостаточно нагрева жидкостей до Твсп. Для обеспечения требуемой интенсивности испарения для устойчивого горения необходим нагрев жидкости до более высокой температуры, называемой температурой воспламенения (Тв).
Для устойчивого горения жидкости необходим нагрев именно до этой температуры. Взрывоопасность жидкостей можно характеризовать как КПР, так и ТП. Температурные пределы - это температуры жидкостей, при которых давление насыщенных паров создает концентрацию паров, соответствующую концентрационному пределу распространения пламени. Зависимость между ТП и КПР выражается следующим образом:

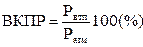
где Рнтп, Рвпт - давление насыщенных паров при нижнем температурном пределе (НТП) и верхнем температурном пределе (ВТП) соответственно;
Ратм - атмосферное давление.
КПР могут выражаться в % объема или в г/м3. Перевод значений КПР из объемных в массовые и наоборот производится по формулам:
Пожарная опасность твердых веществ и материалов характеризуется их склонностью к возгоранию и самовозгоранию. К возгоранию относятся случаи возникновения горения при воздействии внешних источников зажигания с температурой выше температуры самовозгорания (Тсв) К самовозгоранию относятся случаи горения, возникающие при температуре окружающей среды или при умеренном нагреве ниже Тсв.
Различие между возгоранием и самовозгоранием поясняются следующим образом. Представим, что образец твердого материала помещается в воздушный термостат, устанавливаемый на различные заданные температуры. На рис. 1.5 представлены получаемые в этих испытаниях развиваемые во времени в материале температуры. При весьма умеренном нагреве (кривая 1) в материале не происходят изменения. За время, определяемое разностью температур в термостате и окружающей среды, а также теплоемкостью и массой материала температура материала достигнет температуры термостата, а после отключения термостата материал вернется в начальное состояние. Такая картина будет наблюдаться при размещении материала в термостате и с более высокой температурой до тех пор, пока не будет достигнута некоторая начальная температура самонагревания Тсн, при которой начнутся экзотермические превращения в материале (разложение, окисление и др.), ведущие к самонагреванию материала (кривая 2), в процессе которого возможны две ситуации:
1) интенсивность самонагревания невелика, и материал после "исчерпания" способных окисляться компонентов охладится до температуры термостата (кривая 2);
2) в результате самонагревания будет достигнута температура самовозгорания Тсв, начиная с которой произойдет спонтанный рост скорости реакции и температуры и обязательно возникнет горение (кривая 3).

 2020-05-25
2020-05-25 166
166







