С развитием производства металлов (простых веществ) и сплавов связало возникновение цивилизации («бронзовый век», железный век).
Начавшаяся примерно 100 лет назад научно-техническая революция, затронувшая и промышленность, и социальную сферу, также тесно связана с производством металлов. На основе вольфрама, молибдена, титана и других металлов начали создавать коррозионностойкие, сверхтвердые, тугоплавкие сплавы, применение которых сильно расширило возможности машиностроения. В ядерной и космической технике из сплавов вольфрама и рения делают детали, работающие при температурах до 3000 ºС. в медицине используют хирургические инструменты из сплавов тантала и платины, уникальной керамики на основе оксидов титана и циркония.

И конечно же мы не должны забывать, что в большинстве сплавов используют давно известный металл железо (рис. 37), а основу многих легких сплавов составляют сравнительно «молодые» металлы: алюминий и магний.
Сверхновыми стали композиционные материалы, представляющие, например, полимер или керамику, которые внутри (как бетон железными прутьями) упрочнены металлическими волокнами, которые могут быть из вольфрама, молибдена, стали и других металлов и сплавов — все зависит от поставленной цели, необходимых для ее достижения свойств материала.
Вы уже имеете представление о природе химической связи в кристаллах металлов. Напомним на примере одного из них — натрия, как она образуется.
На рисунке 38 изображена схема кристаллической решетки металла натрия. В ней каждый атом натрия окружен восемью соседними. У атомов натрия, как и у всех металлов, имеется много свободных валентных орбиталей и мало валентных электронов.
Единственный валентный электрон атома натрия Зs1 может занимать любую из девяти свободных орбиталей, ведь они не очень отличаются по уровню энергии. При сближении атомов, когда образуется кристаллическая решетка, валентные орбитали соседних атомов перекрываются, благодаря чему электроны свободно нере-мещаются с одной орбитали на другую, осуществляя связь между всеми атомами кристалла металла.
Такой тип химической связи называют металлической. Металлическую связь образуют элементы, атомы которых на внешнем слое имеют мало валентных электронов по сравнению с большим числом внешних энергетически близких орбиталей. Их валентные электроны слабо удерживаются в атоме. Электроны, осуществляющие связь, обобществлены и перемещаются по всей кристаллической решетке в целом нейтрального металла.
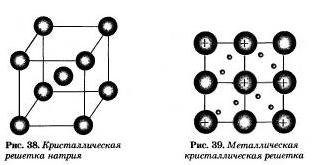
Веществам с металлической связью присущи металлические кристаллические решетки, которые обычно изображают схематически тик, как показано на рисунке узлах находятся катионы и атомы металлов. Обобществленные электроны электростатически притягивают катионы металлов, расположенные в у ал их кристаллической решетки, обеспечивая ее стабильность и прочность (обобществленные электроны изображены в виде черных маленьких шариков).
Металлическая связь — это связь в металлах и сплавах между атом-ионами металле, расположенными в уллах кристаллической решетки, которая осуществляется обобществленными валентными электронами.
Некоторые металлы кристаллизуются в двух или более кристаллических формах. Это свойство веществ — существовать а нескольких кристаллических модификациях — называют полиморфизмом. Полиморфизм для простых веществ вам известен под названием аллотропия.
Олово имеет две кристаллические модификации:
• альфа - устойчива ниже 13,2 ºС с плотностью р - 5.74 г/см3. Это серое олово. Оно имеет кристаллическую решетку типа алмаза (атомную):
• бетта — устойчива выше 13.2 ºС с плотностью р - 6,55 г/см3. Это белое олово.
Белое олово - очень мягкий металл. При охлаждении ниже 13,2 ºС он рассыпается в серый порошок, так как при переходе |1» п значительно увеличивается его удельный объем. Это явление получило название оловянной чумы. Конечно, особый вид химической связи и тип кристаллической решетки металлов должны определять и объяснять их физические свойства.
Каковы же они? Это металлический блеск, пластичность, высокая электрическая проводимость и теплопроводность, рост злектрн чес кого сопротивления при повышении температуры, а также такие практически значимые свойства, как плотность, температуры плавления и кипения, твердость, магнитные свойства.
Давайте попробуем объяснить причины, определяющие основные физические свойства металлов. Почему металлы пластичны?
Механическое воздействие на кристалл с металлической кристаллической решеткой вызывает смещение слоев ион-атомов относительно друг друга, в так как электроны перемещаются но всему кристаллу, разрыв связей не происходит, поэтому дли металлов характерна большая пластичность.
Аналогичное воздействие на твердое вещество с коннлент-кыми связями (атомной кристаллической решеткой) приводит к разрыву ковалентных связей. Разрыв связей в ионной решетке приводит к взаимному отталкиванию одноименно заряженных ионов (рис. 40). Поэтому вещества с атомными и ионными кристаллическими решетками хрупкие.
Наиболее пластичные металлы — это Аu, Af, Cu, Sn, РЪ, Zn. Они легко вытягиваются в проволоку, поддаются ковке, прессованию, прокатыванию в листы- Например, из золота можно изготовить золотую фольгу толщиной 0,008нм, в из 0,5 г этого металла можно вытянуть нить длинной 1 км.
Даже ртуть, к ото рея, как вы знаете, при комнатной температуре жидкая, при низких температурах я твердом состоянии становится ковкой, как свинец. Не обладают пластичностью лишь Bi и Мn, они хрупкие.
 2020-05-25
2020-05-25 149
149








