Лабораторная работа №11
Кислородсодержащие органические соединения
Краткие теоретические сведения
Этиленгликоль и глицерин – бесцветные, вязкие жидкости, хорошо растворимые в воде, имеют высокие температуры кипения. Глицерин –безопасен, а этиленгликоль – сильный яд.
Химические свойства
Для многоатомных спиртов характерны основные реакции одноатомных спиртов. В отличие от них, они могут образовывать производные по одной или по нескольким гидроксильным группам, в зависимости от условий проведения реакций.
1. Многоатомные спирты, как и одноатомные, проявляют свойства кислот при взаимодействии с активными металлами:
CH2–OH CH2–ONa
I + 2 Na → I + H2
CH2–OH CH2–ONa
2. Они способны растворять свежеосаждённый гидроксид меди (II) с образованием внутрикомплексных соединений, в то время как одноатомные спирты с Cu(OH)2 не реагируют:
CH2–OH
2 I + Cu(OH)2 (голубойосадок)→
CH2–OH
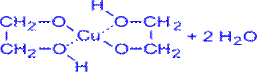
гликолят меди (ярко-синий раствор)
3. Глицерин легко нитруется, давая тринитроглицерин – сильное взрывчатое вещество (основа динамита)
Применение
Этиленгликоль: в качестве антифриза; для синтеза высокомолекулярных соединений (например, лавсана).
Глицерин: в парфюмерии и в медицине (для изготовления мазей, смягчающих кожу); в кожевенном производстве и в текстильной промышленности; для производства нитроглицерина.
Карбоновые кислоты - органические соединения, в молекулах которых содержатся одна или несколько карбоксильных групп, соединённых с углеводородным радикалом или атомом водорода
Классификация карбоновых кислот
1. Одноосновные, двухосновные и многоосновные (в зависимости от числа функциональных групп),
2.Предельные, непредельные и ароматические (в зависимости от строения радикала).
Общая формула предельных одноосновных кислот:
Атом «Н» в группе «- OH» в кислотах гораздо более подвижен, чем в молекулах спиртов. Поэтому растворимые в воде карбоновые кислоты диссоциируют:
Номенклатура.
а) исторически сложившиеся названия кислот: муравьиная, уксусная, пропионовая, масляная, валериановая, капроновая, энантовая;
б) по международной номенклатуре - от названий соответствующих углеводородов + "овая" с прибавлением слова "кислота".
Пример: Н-СООН муравьиная или метановая, СН3-СООН уксусная или этановая кислоты.
O O
// //
R - C или CnH2n+1 - C
\ \
OH O - H
O
//
R - C ⇆ R - COO- + H+.
\
O - H
Получение
В лаборатории карбоновые кислоты можно получить из их солей, действуя на них серной кислотой при нагревании, например: 2СН3 – СООNa + H2SO4® 2СН3 – СООН + Na2SO4
В промышленности получают окислением углеводородов, спиртов и альдегидов.
Химические свойства
1. Из-за смещения электронной плотности от гидроксильной группы O–H к сильно поляризованной карбонильной группе C=O молекулы карбоновых кислот способны к электролитической диссоциации: R–COOH → R–COO- + H+
Сила карбоновых кислот в водном растворе невелика.
2. Карбоновые кислоты обладают свойствами, характерными для минеральных кислот. Они реагируют с активными металлами, основными оксидами, основаниями, солями слабых кислот.
2СH3COOH + Mg → (CH3COO)2Mg + H2
2СH3COOH + СaO → (CH3COO)2Ca + H2O
H–COOH + NaOH → H–COONa + H2O
2СH3CH2COOH + Na2CO3 → 2CH3CH2COONa + H2O + CO2
СH3CH2COOH + NaHCO3 → CH3CH2COONa + H2O + CO2
Карбоновые кислоты слабее многих сильных минеральных кислот (HCl, H2SO4 и т.д.) и поэтому вытесняются ими из солей: СH3COONa + H2SO4(конц.) →CH3COOH + NaHSO4
3. Образование функциональных производных:
при взаимодействии со спиртами (в присутствии концентрированнойH2SO4) образуются сложные эфиры. Образование сложных эфиров при взаимодействии кислоты и спирта в присутствии минеральных кислот называется реакцией этерификации (ester с латинского "эфир").
CH3–  –OH + HO–CH3DCH3–
–OH + HO–CH3DCH3–  –OCH3 + H2O
–OCH3 + H2O
уксусная кислота метиловый спирт метиловый эфир уксусной кислоты
Обратной реакцией является гидролиз (омыление) сложного эфира:
CH3–  –OCH3 + HO–H DCH3–
–OCH3 + HO–H DCH3–  –OH + CH3OH.Как видно, процесс этерификации обратимый.
–OH + CH3OH.Как видно, процесс этерификации обратимый.
Применение
Муравьиная кислота – в медицине, в пчеловодстве, в органическом синтезе, при получении растворителей и консервантов; в качестве сильного восстановителя.
Уксусная кислота – в пищевой и химической промышленности (производство ацетилцеллюлозы, из которой получают ацетатное волокно, органическое стекло, киноплёнку; для синтеза красителей, медикаментов и сложных эфиров).
Масляная кислота – для получения ароматизирующих добавок, пластификаторов и флотореагентов.
Щавелевая кислота – в металлургической промышленности (удаление окалины).
Стеариновая C17H35COOH и пальмитиноваякислота C15H31COOH – в качестве поверхностно-активных веществ, смазочных материалов в металлообработке.
Олеиновая кислота C17H33COOH – флотореагент и собиратель при обогащении руд цветных металлов.
Главной составной частью растительных и животных жиров являются сложные эфиры глицерина и высших жирных кислот (предельных – C15H31COOH пальмитиновой, C17H35COOH – стеариновой; непредельных C17H33COOH – олеиновой; C17H31COOH – линолевой; C17H29COOH – линоленовой).
Первый синтез жира осуществил Бертло (1854 г.) при нагревании глицерина и стеариновой кислоты:
Физические свойства
Жиры, образованные предельными кислотами – твёрдые вещества, а непредельными – жидкие. Все жиры очень плохо растворимы в воде.
Химические свойства
1. Гидролиз (омыление) в кислой или в щелочной среде, или под действием ферментов:

В щелочной среде образуются мыла – соли высших жирных кислот (натриевые – твёрдые, калиевые – жидкие).
Все загрязнения гидрофобны, вода их плохо смачивает, поэтому стирать в чистой воде малоэффективно. Молекула кислотного остатка состоит из двух частей: радикала R, который выталкивается водой, и группы –COO-, которая полярна, гидрофильна и легко прилипает к частицам загрязнения. В мыльном растворе вода, выталкивая из своей среды углеводородные радикалы удаляет вместе с ними и группу –СОО-, которая адсорбирована на поверхности загрязняющей частицы, и тем самым загрязнение удаляется вместе с кислотным остатком.
Обычное мыло плохо стирает в жёсткой воде и совсем не стирает в морской воде, так как содержащие в ней ионы кальция и магния дают с высшими кислотами нерастворимые в воде соли: 2RCOO- + Ca → (RCOO)2Ca$
В современных моющих средствах часто используют натриевые соли высших алкилсульфокислот, которые не связываются ионами Ca в нерастворимые соли.
Гидрирование (гидрогенизация) – процесс присоединения водорода к остаткам непредельных кислот, входящих в состав жира. При этом остатки непредельных кислот переходят в остатки предельных, и жидкие растительные жиры превращаются в твёрдые (маргарин).
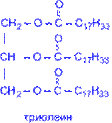
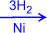
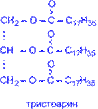
3. Количественной характеристикой степени ненасыщенности жиров служит йодное число, показывающее сколько г йода может присоединиться по двойным связям к 100 г жира.
При контакте с воздухом происходит прогоркание жиров, в основе которого лежит окисление по двойным связям (образуются альдегиды и кислоты с короткой цепью) и гидролиз под действием микроорганизмов
 2020-05-25
2020-05-25 123
123






