Для установления границ термодинамической возможности протекания электрохимической коррозии металлов обычно используют диаграммы Пурбе (диаграммы состояний системы металл–вода).Они дают информацию о термодинамическом равновесии между металлом, его ионами в растворе или нерастворимыми продуктами реакции, для разных электродных потенциалов φ (в вольтах по водородной шкале) металла и различных pH водного раствора. Эти диаграммы позволяют оценить возможности протекания процесса коррозии металлов.
Диаграммы учитывают три типа равновесия в системе металл - вода:
- Равновесия, связанные с обменом электрическими зарядами
Ме = Ме n+ + ne.
Эти равновесия определяются только величиной потенциала и не зависят от рН. Линии, характеризующие эти равновесия, параллельны оси рН.
- Равновесия, не связанные с обменом электрическими зарядами
МеОН, = Ме n+ + n ОН-
Эти равновесия определяются только величиной рН и не зависят от потенциала. Линии, характеризующие эти равновесия, параллельны оси потенциалов.
Равновесия, зависящие как от потенциала, так и от рН, например на металл-оксидных электродах
Ме + nОН- = Ме(OН)n+ nе.
Потенциал такого электрода определяется уравнением
Е ОН /Ме = Е ОН Ме - 0,059 рН.
Из уравнения видно, что линия равновесия имеет наклон, аналогичный наклону, характеризующему изменение потенциала водородного электрода. Наклон линии равновесия от величины рН в других случаях определяется, исходя из уравнения конкретной электродной реакции.
На рисунке.18 приведены диаграммы Пурбе для цинка и железа. Диаграмма для цинка имеет четыре области: I - область термодинамической устойчивости; II, IV - области коррозии и III - область пассивности. Линии диаграммы отвечают следующим равновесиям:
1 - Zn = Zn2+ + 2e;
2 - Zn2+ + 2OH- = Zn(OH)2;
3 - Zn + 2OH- = Zn(OH)2 + 2e;
4 - Zn(OH)2 + 2OH- = ZnO22- + 2H2O;
5 - Zn + 2H2O = ZnO22- + 4H+ + 2e.
Таким образом, в области II устойчив ион цинка, в области IV-ион цинката. Пассивность цинка в области III обусловлена образованием пленки нерастворимого гидроксида Zn(ОH)2.На рис.3, б приведена диаграмма Пурбе для железа, на которой также обозначены области его термодинамической устойчивости и различные продукты окисления.
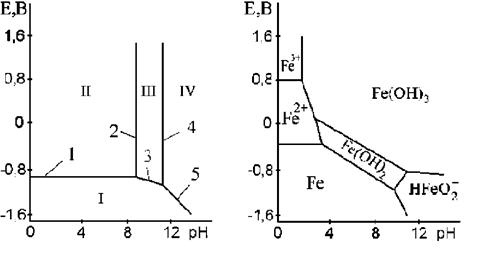
Рисунок. 18. - Диаграммы Пурбе для:
а - цинка; б - железа.
Упрощенная диаграмма E–рН для системы Fe–H2O при температуре 25°С представлена на рисунке 19.
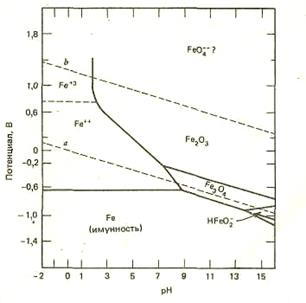
Рисунок 19 – Упрощенная диаграмма Пурбе для железа
Диаграмма состоит из отдельных областей, разграниченных линиями, относящимися к протеканию определенного равновесного процесса.
Горизонтальные линии соответствуют реакциям, протекающим без участия ионов H+ или OH–,т.е. равновесие, определяемое величиной потенциала и не зависящее от pH,
Fe ↔ Fe2+ +2 e –.
Вертикальные линии указывают на реакции с участием ионов H+ или OH–,но без участия электронов, т.е. равновесия, не зависящие от потенциала:
Fe2+ + 3H2O= Fe(OH)3 + 3H+.
Непрерывные линии определяют границы участков термодинамической устойчивости (I), коррозии (II) и пассивности (III) железа при разных значениях потенциала и pH. Все наклонные линии соответствуют равновесию процессов окисления и восстановления, зависящих от pH.
Наклонная (пунктирная) линия 1 выражает равновесный потенциал водородного электрода в зависимости от pH, линия 2 – равновесный потенциал кислородного электрода. Потенциал как водородного, так и кислородного электрода уменьшается на 0,059 В или 59 мВ при возрастании pH на единицу. Между пунктирными линиями 1 и 2 находится область термодинамической устойчивости воды, ниже линии 1 происходит восстановление воды с выделением водорода, выше линии 2 – окисление воды с выделением кислорода.
На практике обычно требуется поддерживать несколько больший потенциал, чем соответствующий линии 2 для обеспечения выделения кислорода, и несколько меньший, чем соответствующий линии 1 для обеспечения выделения водорода.
Этот дополнительный сдвиг потенциала (или перенапряжение) для всех металлов различен, а для данного металла зависит от свойств окружающей среды, поверхностных пленок и состояния поверхности.
Приведенная диаграмма указывает на существование двух областей коррозии железа: одной, где образуются ионы Fe2+ и Fe3+(в средах с pH < 9) и другой, где возникают ионы гипоферрита HFeO2– (в сильнощелочных средах).
С помощью диаграммы Пурбе можно определить, при каких значениях pH и потенциала могут наступить коррозия или полное пассивное состояние металла, какой состав имеют образующиеся оксиды и гидроксиды, при каких условиях возможна электрохимическая защита металла.
На рисунке 20 представлена диаграмма для системы цинк-вода
Выполнение работы
Проведите расчет и построение упрощенной диаграммы Пурбе для цинка.
Порядок выполнения расчета.
Металл -цинк. E°Zn2+/Zn = -0,763B(н.в.э.).
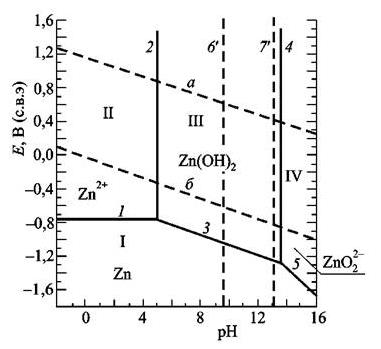
Рисунок 20- Упрощенная диаграмма Пурбе для системы цинк-вода
1. 2Н+ + 2е- = Н2
Е(2н+/н2) = 0,186 - 0,059 рН (штриховая линия «а»)
асчет при рН 0, 2, 4, 6, 8, 10, 12, 14
2. 2Н2О = О2 + 4Н+ + 4е- (рН < 7) 4ОН- = О2 + 2Н2О + 4е- (рН > 7)
Ео2/он- = 1,217 - 0,059 рН (штриховая линия Расчет при рН от 0 до 14
3. Zn = Zn2+ + 2e-
E = - 0,763 + 0,0295 lg [ Zn2+ ] Расчет при lg [Zn2+] = 0, -2, -4, -6. Провести сплошную линию AB при рZn2+ = 6 от рН = 0 до рН ~ 8,8 (вертикаль1).
4. Zn + 2Н2О = Zn(OH)2 (ш) + 2Н+ +2е-E = -0,40 - 0,059 рН
Расчет при рН = 8, 10, 11. Провести сплошную линию BC до вертикали 2 при рН = 11.
5. Zn + 2H2O = HZnO2- + 3H+ + 2e-
E = 0.054 - 0,0886рН + 0,0295 lg [HZnO2-] Расчет при рН 11, 12, 13 и [HZnO2-] = 10-6M. Провести сплошную линию CD.
6. Zn + 2H2O = ZnO22- + 4H+ + 2e-
E = 0,441 - 0,118 рН + 0,0295 lg [ZnO22-] Расчет при рН = 13 и 14 и [ZnO22-]= 10-6M.
Провести сплошную линию DE. Построить упрощенную диаграмму Пурбе для цинка в координатах E (-1,5...+2В) - рН (0 - 14).
Указать на диаграмме области стабильности цинка (ниже линии АВСДЕ), пассивности (между вертикалями 1 (рН~8,8) и 2 (рН =11) и коррозии цинка (две области) и вид катодной деполяризации.
 2020-06-12
2020-06-12 1715
1715
