Химические свойства металлов
Оборудование: магниевая лента, щипцы, спиртовка, спички, натрий, скальпель, пинцет, фильтр. бумага, вода, ф/ф, чашка Петри, Zn, Mg, Cu, Al (гранулы) растворы HCl, CuCl2, ZnCl2, NaOH, CH3COOH, C2H5OH, 10 пробирок, порошок Al, I2, стакан без носика, пипетка.
Ход урока:
· Фронтальный опрос:
Ø Охарактеризуйте положение металлов в ПС и особенности строения их атомов.
Ø Что такое металлическая связь? Какие электроны называют свободными? Особенности металлической кристаллической решётки.
Ø Перечислите основные физические свойства металлов. Чем они обусловлены?
Ø Назовите: самый тяжелый и самый легкий металл; самый легкоплавкий и тугоплавкий; мягкий и самый твердый металл; самый блестящий; самый пластичный; лучшие проводники электричества и тепла.
· Особенности строения атомов металла таковы, что металлы легко отдают валентные электроны, проявляя свойства восстановителя: М0 – ne → Mn+ (восстановитель, окисляется). Чтобы произошла эта реакция, необходимо наличие окислителя. Вспомним, какие вещества могут выступать в роли окислителя? (Неметаллы, вода, кислоты, соли)
- Взаимодействие металлов с неметаллами
Опыт: горение магниевой ленты, Al + I2.
2Mg + O2 = 2MgO (оксид магния) – реакция соединения, экзотермическая, требуется нагревание для начала реакции. Образуется бинарное соединение с ионной связью, суффикс –ид. Pt, Au не окисляются, Al – Pb образуют оксидные плёнки, ЩМ (кроме Li) образуют пероксиды и надпероксиды, Fe - окалина.
v Закончите уравнения реакций, назовите продукты:
Ag + O2 → Li + N2 → Al + C → Mg + Si →
Zn + S → Ca + P → Mg + H2 → Fe + Cl2 →
- Взаимодействие металлов с водой
Ряд активности металлов составлен русским ученым Н.Н. Бекетовым в зависимости от способности атомов металлов отдавать электроны в водных растворах. Слева направо восстановительная способность атомов металлов уменьшается, а окислительная способности ионов металлов увеличивается.
Опыт: взаимодействие натрия с водой.
Li……………………………..Al…………………………………H……………………………..Au
При обычной температуре При нагревании Не реагируют
гидроксид + Н2 оксид + Н2
v Составьте по два уравнения реакций для металлов до и после Al, укажите окислитель и восстановитель.
- Взаимодействие металлов с растворами кислот (кроме азотной и серной конц.)
Опыт: Zn, Mg, Cu + HCl
Металлы, стоящие в РАМ до водорода, вытесняют водород из кислот, с образованием растворимых солей: M + кислота → растворимая соль + Н2.
v Закончите уравнения возможных реакций, укажите окислитель и восстановитель, составьте ионные уравнения реакций:
Ca + HCl → Al + H2SO4 (p-p) → Ba + H3PO4 →
Ag + HF → Fe + HCl → Mg + H2SO4 (p-p) →
Серная концентрированная
Li……………………………..Al…………………………………H……………………………..Au
H2S S SO2
Азотная концентрированная
Li……………………………..Al…………………………………H……………………………..Au
NH4NO3 N2 или N2O NO
Азотная разбавленная
Li……………………………..Al…………………………………H……………………………..Au
N2 или N2O NO NO2
Al, Cr, Fe пассивируются концентрированной серной и азотной кислотами
Au + HNO3 + 4HCl → H[AuCl4] + NO + 2H2O
- Взаимодействие металлов с растворами солей
Опыт: Zn + CuCl2, Cu + ZnCl2
Левее стоящие металлы вытесняют правее стоящие металлы из растворов их солей:
M1 + раствор соли М2 → растворимая соль М1 + М2.
v Закончите уравнения возможных реакций, укажите окислитель и восстановитель, составьте ионные уравнения реакций:
Mg + CoCl2 → Cu + AgCl → Pb + AgNO3 →
Sn + FeCl3 → Pb + Cr2(SO4)3 → Fe + Cu(NO3)2
Металлы могут реагировать с солями окислителями
а) за счет аниона: KClO3 + 3Mg → KCl + 3MgO
3KNO3 + 2Al → Al2O3 + 3KNO2
б) за счет катиона: 2FeCl3 + Cu → 2FeCl2 + CuCl2
- Взаимодействие с оксидами
Mg и Al имеют очень низкие значения ∆G образования оксидов, способны восстанавливать другие металлы и некоторые неметаллы из их оксидов:
Al + Cr2O3
Mg + SiO2
- Взаимодействие со щелочами
Переходные металлы (Al, Zn, Cr, Fe с трудом) реагируют с расплавами и растворами щелочей с выделением водорода
Опыт: Al + раствор NaOH, собрать и сжечь водород.
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
- Взаимодействуют с органическими веществами с кислотными свойствами (ацетиленовые, спирты, фенолы, карбоновые кислоты)
Опыт: Mg + уксусная кислота, Na +спирт
Составить уравнения всех реакций
- Взаимодействие с галогенпроизводными углеводородов
а) реакция Вюрца (внутримолекулярная и межмолекулярная)
б) получение реактива Гриньяра
в) получение тетраэтилсвинца (антидетонатор, добавка к бензину)
4C2H5Cl + Pb(Na) (сплав) → Pb(C2H5)4 + 4NaCl
Переходные металлы (решить
Любые две цепочки)
Cu → CuO → Cu(NO3)2 → Cu(OH)2 → CuSO4 → Cu → CuCl2 → Cu(OH)2 → глицерат Cu(II)
Zn → ZnS → ZnCl2 → Zn(OH)2 → K2[Zn(OH)4]
└→ ZnO → ZnSO4 → Zn → ацетат цинка
Cr → CrSO4 → Cr(OH)2 → Cr(OH)3 → Cr2O3 → Cr → Cr2S3 →SO2
└→ Na3[Cr(OH)6]
Fe → FeCl3 → Fe(OH)3 → Fe2O3 → Fe → FeSO4 → Fe(OH)2 → FeO → Fe → FeCl2 → AgCl → → Ag → AgNO3 → [Ag(NH3)2]OH → 2Ag
Mn → X1 → Mn(NO3)2 → X2 → K2MnO4 → X3 → Mn
Cu → CuO → Cu(NO3)2 → Cu(OH)2 → CuSO4 → Cu → CuCl2 → Cu(OH)2 → глицерат Cu(II)
Zn → ZnS → ZnCl2 → Zn(OH)2 → K2[Zn(OH)4]
└→ ZnO → ZnSO4 → Zn → ацетат цинка
Cr → CrSO4 → Cr(OH)2 → Cr(OH)3 → Cr2O3 → Cr → Cr2S3 →SO2
└→ Na3[Cr(OH)6]
Fe → FeCl3 → Fe(OH)3 → Fe2O3 → Fe → FeSO4 → Fe(OH)2 → FeO → Fe → FeCl2 → AgCl → → Ag → AgNO3 → [Ag(NH3)2]OH → 2Ag
Mn → X1 → Mn(NO3)2 → X2 → K2MnO4 → X3 → Mn
Cu → CuO → Cu(NO3)2 → Cu(OH)2 → CuSO4 → Cu → CuCl2 → Cu(OH)2 → глицерат Cu(II)
Zn → ZnS → ZnCl2 → Zn(OH)2 → K2[Zn(OH)4]
└→ ZnO → ZnSO4 → Zn → ацетат цинка
Cr → CrSO4 → Cr(OH)2 → Cr(OH)3 → Cr2O3 → Cr → Cr2S3 →SO2
└→ Na3[Cr(OH)6]
Fe → FeCl3 → Fe(OH)3 → Fe2O3 → Fe → FeSO4 → Fe(OH)2 → FeO → Fe → FeCl2 → AgCl → → Ag → AgNO3 → [Ag(NH3)2]OH → 2Ag
Mn → X1 → Mn(NO3)2 → X2 → K2MnO4 → X3 → Mn
Cu → CuO → Cu(NO3)2 → Cu(OH)2 → CuSO4 → Cu → CuCl2 → Cu(OH)2 → глицерат Cu(II)
Zn → ZnS → ZnCl2 → Zn(OH)2 → K2[Zn(OH)4]
└→ ZnO → ZnSO4 → Zn → ацетат цинка
Cr → CrSO4 → Cr(OH)2 → Cr(OH)3 → Cr2O3 → Cr → Cr2S3 →SO2
└→ Na3[Cr(OH)6]
Fe → FeCl3 → Fe(OH)3 → Fe2O3 → Fe → FeSO4 → Fe(OH)2 → FeO → Fe → FeCl2 → AgCl → → Ag → AgNO3 → [Ag(NH3)2]OH → 2Ag
Mn → X1 → Mn(NO3)2 → X2 → K2MnO4 → X3 → Mn
Проработать Вариант № 1554249
1. Установите соответствие между уравнением реакции и формулой вещества, играющего в этой реакции роль восстановителя.
| Уравнение реакции | Формула восстановителя |
А) 
| 1) 
|
Б) 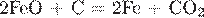
| 2) 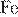
|
В) 
| 3) 
|
Г) 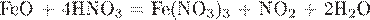
| 4) 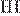
|
5) 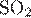
| |
6) 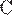
|
2. Установите соответствие между уравнением реакции и свойством азота, которое он проявляет в этой реакции.
| УРАВНЕНИЕ РЕАКЦИИ | СВОЙСТВО АЗОТА | |
А) 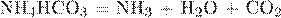 Б)
Б)  В)
В) 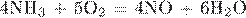 Г)
Г) 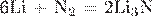
| 1) окислитель 2) восстановитель 3) и окислитель, и восстановитель 4) не окислитель, не восстановитель |
3. Взаимодействие цинка с соляной кислотой относится к реакциям:
1) каталитическим
2) гомогенным
3) обратимым
4) окислительно-восстановительным
5) замещения
Запишите номера выбранных типов реакций.
4. Взаимодействие меди с раствором нитрата серебра – это реакция
1) замещения
2) обмена
3) окислительно-восстановительная
4) соединения
5) разложения
В ответе укажите два верных утверждения.
5. Реакцией замещения является взаимодействие хлорэтана с
1) 
2) 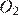
3) 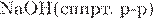
4) 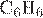
5) 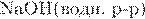
6. Для снижения скорости реакции

необходимо
1) понизить температуру
2) повысить давление
3) добавить ингибитор
4) повысить температуру
5) повысить концентрацию водорода
В ответе укажите два верных утверждения.
7. Для увеличения скорости реакции гидролиза 1-бромбутана необходимо
1) повысить температуру
2) добавить кислоту
3) понизить концентрацию 1-бромбутана
4) добавить катализатор
5) повысить концентрацию бутанола
В ответе укажите два верных утверждения.
8. Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе её водного раствора.
| ФОРМУЛА СОЛИ | ПРОДУКТ НА КАТОДЕ | |
А) 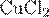 Б)
Б) 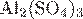 В)
В) 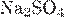 Г)
Г) 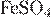
| 1) медь 2) хлор 3) железо, водород 4) водород 5) железо 6) калий |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
| A | Б | В | Г |
9. Установите соответствие между формулой вещества и продуктом, выделяющимся на аноде при электролизе водного раствора этого вещества.
| ФОРМУЛА ВЕЩЕСТВА | АНОДНЫЙ ПРОДУКТ | |
А) 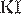 Б)
Б) 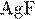 В)
В) 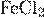 Г)
Г) 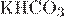
| 1) кислород 2) металл 3) иод 4) фтор 5) углекислый газ 6) хлор |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
| A | Б | В | Г |
10. Установите соответствие между названием соли и её отношением к гидролизу.
| ФОРМУЛА СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ | |
А)  Б)
Б) 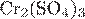 В)
В) 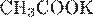 Г)
Г) 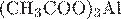
| 1) гидролизуется по катиону 2) гидролизуется по аниону 3) гидролизуется по катиону и аниону 4) не гидролизуется |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
| A | Б | В | Г |
11. Установите соответствие между формулой соли и типом гидролиза её водного раствора.
| ФОРМУЛА СОЛИ | ТИП ГИДРОЛИЗА | |
| A) NH4NO3 Б) AgCl B) AlCl3 Г) Na2CO3 | 1) по катиону 2) по аниону 3) не подвергается гидролизу |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
| A | Б | В | Г |
12. Установите соответствие между формулой соли и характером среды её разбавленного водного раствора.
| ФОРМУЛА СОЛИ | ХАРАКТЕР СРЕДЫ | |
А) 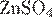 Б)
Б) 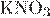 В)
В) 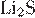 Г)
Г) 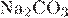
| 1) нейтральная 2) сильно кислая 3) слабо кислая 4) щелочная |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
| А | Б | В | Г |
13. Установите соответствие между уравнением обратимой химической реакции и направлением смещения химического равновесия при увеличении давления.
| УРАВНЕНИЕ РЕАКЦИИ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ | |
А)  Б)
Б) 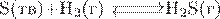 В)
В) 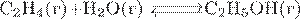 Г)
Г) 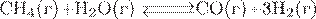
| 1) в сторону продуктов реакции 2) в сторону исходных веществ 3) положение равновесия не зависит от давления |
| А | Б | В | Г |
14. Установите соответствие между уравнением обратимой химической реакции и факторами, способствующими смещению равновесия в сторону реагентов.
| УРАВНЕНИЕ РЕАКЦИИ | ФАКТОРЫ, СПОСОБСТВУЮЩИЕ СМЕЩЕНИЮ РАВНОВЕСИЯ В СТОРОНУ РЕАГЕНТОВ | |
А) 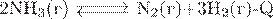 Б)
Б) 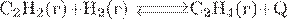 В)
В)  Г)
Г) 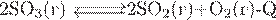
| 1) нагревание, уменьшение давления 2) охлаждение, уменьшение давления 3) охлаждение, увеличение давления |
| А | Б | В | Г |
15. Верны ли следующие суждения о смещении химического равновесия в системе 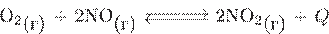 ?
?
А. При повышении температуры химическое равновесие в данной системе сместится в сторону исходных веществ.
Б. При увеличении концентрации оксида азота (II) равновесие системы сместится в сторону исходных веществ.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Результаты
| № п/п | Правильный ответ |
| 1 | 3651 |
| 2 | 4221 |
| 3 | 45 |
| 4 | 13 |
| 5 | 45 |
| 6 | 13 |
| 7 | 14 |
| 8 | 1443 |
| 9 | 3161 |
| 10 | 4123 |
| 11 | 1312 |
| 12 | 3144 |
| 13 | 2312 |
| 14 | 3113 |
| 15 | 1 |
 2020-06-08
2020-06-08 75
75






