Теперь можно приступать к выплавлению модельного состава и прокаливанию форм. При выборе температурных режимов необходимо учитывать фазовые превращения в гипсодинасовой смеси, ее низкую газопроницаемость. Так, выделяющиеся пары воды могут привести к возрастанию давления внутри пор формы и появлению трещин. Именно этим определяется малая скорость прокаливания (0,02—0,03°С/с) и относительно длительная выдержка при температурах фазовых превращений.
После вывяливания опоки помещают в печь вытапливания, где их выдерживают при 120°С в течение 8 ч литниковой чашей вниз. Расплавленная модельная масса частично впитывается в поры гипсодинасовой смеси (до 60-70% общего количества модельной массы — в зависимости от сложности гравюры и развитости поверхности) частично стекает в специальную емкость под опокой. Выплавленную таким образом модельную массу используют для изготовления менее ответственных изделий [2, 6]. Далее опоки либо переставляют в печь прокаливания, либо продолжают прокаливать в той же печи, предварительно удалив емкость для сбора модельной массы. Режим прокаливания зависит от состава формовочной массы, диаметра и высоты опоки. Для опок диаметром 70 мм и высотой 150 мм режим прокаливания следующий: нагрев до 220°С со скоростью 0,02°С/с и выдержка 1 ч; нагрев до 350-370°С со скоростью 0,025°С/с и выдержка 4-5 ч; нагрев от 370 до 480°С со скоростью 0,025°С/с и выдержка при 480°С 1 — 1,5 ч; нагрев от 480 до 740~800°С со скоростью 0,05°С/с и выдержка при 740~800°С 1,5-2 ч. После этого печь переводят на режим охлаждения со скоростью 0,03° С/с до температуры формы при заливке (по данным работы [3], — до 250°С/ч).
Чем меньше толщина стенки отливки, тем выше должна быть температура формы при заливке. Так, для женских колец, сережек и т. п. — 480—540°С, для мужских колец — 370-480°С, для отливок толщиной более 3-5 мм — 200-450°С. При температуре заливки форма должна выдерживаться не менее 1—2 ч; общая продолжительность выдержки 14—16 ч. Режим обжига форм, по Л. А. Гутову [2], приведен в табл. 3.
Таблица 3. Режим обжига форм
| Стадия обжига | Температура обжига, °С | Продолжительность обжига, ч |
| Удаление влаги | 20-125 | 0,5-1,0 |
| Удаление воды из гипса: | ||
| до CaSO4 • 1,5 Н2О | 125-130 | 1,0-1,5 |
| до CaSO4 • 0,5 Н2О | 135-160 | 1,0-1,5 |
| Выплавление модельной массы | 110-200 | 0,5-1,0 |
| Превращение β —> а -кристобалит | 180-270 | 1,0-1,5 |
| Превращение полугидратного гипса CaSO4 • 0,5 Н2О в «мертвый» | 320-370 | 0,5-1,0 |
| Начало спекания формовочной смеси | 450-535 | 0,5-1,0 |
| Превращение (β —> а -кварц | 535-575 | 0,5-1,0 |
| Выжигание остатков модельной массы | 600-800 | 1,0-1,5 |
| Упрочнение безводного гипса CaSO4 + SiO2 <==> CaSiO3 + SO3 | 800 | 0,5 |
| Охлаждение форм перед заливкой | 640-20 | 1,5-2,0 |
| ИТОГО | 7,5-12 | |
Для смеси «SATIN CAST 20» в зависимости от размера опок рекомендуемые режимы прокаливания представлены в табл. 4.
Из приведенных данных следует, что выбор режимов прокаливания форм определяется составом гипсодинасовой смеси и качеством ее приготовления. По крайней мере, для отечественных смесей даже одного замеса (обычно 12 бочек по 40 кг) необходимо корректировать режим прокаливания форм из смесей разных бочек.
Таблица 4. Режимы прокаливания опок из смеси «SATINCAST 20»
| Размеры опок, мм | Температура, °С | Продолжительность выдержки, ч |
| Диаметр-63 Высота-63 | 149 | 1 |
| 371 | 1 | |
| 732 | 2 | |
| При заливке | 1 | |
| Итого | 5 | |
| Диаметр-89 Высота-100 | 149 | 2 |
| 371 | 2 | |
| 732 | 3 | |
| При заливке | 1 | |
| Итого | 8 | |
| Диаметр-100 Высота-200 | 149 | 2 |
| 315 | 2 | |
| 482 | 2 | |
| 732 | 4 | |
| При заливке | 2 | |
| Итого | 12 |
В процессе прокаливания в печи необходимо поддерживать окислительную атмосферу, чтобы продукты деструкции модельного состава полностью газифицировались, в том числе произошло полное окисление образующегося пироуглерода во внутренних частях формы. Иначе рабочая поверхность формы окажется шероховатой, а качество отливок невысоким. Это связано с тем, что пироуглерод может смываться потоком расплава и замешиваться в металл, повышая количество неметаллических включений.
Пока прокаливается форма, можно приступить к плавке металла, стремясь, чтобы прокаливание и плавление закончились одновременно [10, 11].
Таблица 5. Цветовые оттенки медных двойных сплавов с оловом или цинком
| Количество меди, % | Цвет сплава меди | |
| с оловом | с цинком | |
| 99 | Бледно-красный | Красный |
| 96 | Бледно-розовый | Красный с желтизной |
| 92 | Красновато-желтый | Коричнево-красный |
| 90 | Оранжево-желтый | Красно-желтый |
| 85 | Желтый | Желто-красный |
| 80 | Желтый с золотистым отливом | Красновато-желтый |
| 75 | Голубовато-красный | Светло-желтый |
| 73 | Темно-серый | Желтый |
| 70 | Белый | Желтый |
| 65 | Голубовато-белый | Ярко-желтый |
| 50 | Светло-серый | Золотисто-желтый |
Для художественного литья в основном применяются сплавы на медной основе, позволяющие получать различные цветовые оттенки отливок (табл. 5), включая имитацию золота и его сплавов (цыганское золото, хризокальк, симилор или майнгемское золото); серебра и его сплавов (мельхиор, нейзильбер, белая бронза) при соответствующих физико-механических и эксплуатационных свойствах (адмиралтейская бронза, шпеактр, бидар, куниаль); требуемые технологические литейные свойства; высокую коррозионную стойкость в различных средах, включая агрессивные (кислотные и щелочные дожди и т.п.); эмалированные и патинированные; сварные и паяные изделия. Прежде всего, это бронзы для художественного литья: БХ1 (для отливок бюстов, статуй), БХ2 (крупное декоративное литье), БХЗ (мелкое декоративное литье); классические оловянистые бронзы; бронзы БрОЗ Ц7 С5 HI, БрА7, БрА9 Ж4, БрМц5 и многие другие. Хорошими литейными свойствами и красивым золотистым цветом обладают латуни (табл. 5): ЛЦК 17-3; ЛЦКС 14—3—3; ЛА 85—0,5, Л90 и др. В художественном литье широкое распространение находят и медно-никелевые сплавы — нейзильберы: МН15 Ц20; MHI5 Ц30 К0,3; МН16 Ц29; МН16 Ц29 С18 и др.
Рассмотрим некоторые физико-химические процессы, протекающие при плавлении металла. При испарении компонентов сплава во время плавки может существенно измениться химический состав отливки. Наиболее активно испаряются кадмий, цинк, магний, свинец (табл. 6).
Таблица 6. Давление пара некоторых металлов над чистым металлом
| Металл | Давление пара, Па, при температуре, °С | |||||
| 600 | 800 | 1000 | 1200 | 1400 | 1600 | |
| Mg | 130 | 3986 | 39931 | 207606 | 711245 | 1840 |
| Al | 4,34 • 10-8 | 1,1 • 10-4 | 0,025 | 1,2 | 23 | 229 |
| Zn | 1433 | 30144 | 235479 | 1027441 | 3094565 | |
| Fe | 1,2 • 10-11 | 1,5 • 10-7 | 9 • 10-5 | 0,01 | 0,3 | 5 |
| Ni | 3 • 10-14 | 1,1 • 10-9 | 1,7 • 10-6 | 3 • 10-5 | 6,02 | 0,34 |
| Pb | 0,06 | 6,9 | 177 | 1847 | 10808 | 42830 |
| Cu | 3,6 • 10-9 | 1,6 • 10-5 | 0,005 | 0,32 | 7,4 | 85,2 |
| Ag | 8 • 10-6 | 0,007 | 0,7 | 20,5 | 257 | 1852 |
Это свойство используется при рафинировании расплавов. Например, в работе [4] указывается, что около 0,5% Cd позволяет при плавке легко вывести большое количество оксидов: «при этом необходимо дать расплаву выдержку, чтобы произошло полное выделение паров CdO и остатков чистого кадмия. Этот способ раскисления расплава является наиболее приемлемым и безопасным».
Кислород в медных сплавах образует не только свободные оксиды, но и растворы с компонентами сплава. Известно, что металл не растворяет солей и оксидов других металлов, а растворяет лишь свои низшие оксиды (закиси) и соединения, обладающие полупроводниковыми свойствами. В работе [7] указывается следующая зависимость: если металлы расположить по возрастанию температуры плавления, то окажется, что легкоплавкие металлы от олова до алюминия не растворяют кислород, а серебро и более тугоплавкие — образуют твердые и жидкие растворы.
Таблица 7. Равновесное давление кислорода (в десятичных логарифмах) над оксидами некоторых металлов в зависимости от температуры
| Оксид | 600°C | 800°C | 1000°C | 1200°C | 1400° С | 1600° С |
| MgO | < -25 | < -25 | <-25 | < -25 | <-25 | <-17 |
| Аl2О3 | < -25 | <-25 | <-25 | -24 | -19 | -12 |
| ZnO | -26 | -19 | -13 | -5 | -3 | 0 |
| FeO | -20 | -14 | -10 | -7 | -5 | -3 |
| NiO | -18 | -12 | -7 | -4 | 1 | 3 |
| PbO | -14 | -8 | -4 | -1 | 1 | 3 |
| Cu2O | -5 | -4 | -1 | 1 | 3 | 4 |
| Ag2O | 6 | 8 | 10 | > 10 | > 10 | > 10 |
В большинстве металлических расплавов растворимость кислорода с понижением температуры уменьшается. Однако газы в металлах, в том числе и кислород, могут растворяться только в атомном состоянии. Особенность поведения кислорода состоит в том, что этот газ при кристаллизации и последующем охлаждении сплава никогда не выделяется в свободном состоянии. При этом кислород из жидкого раствора либо целиком остается в твердом растворе, либо переходит в жидкие или твердые оксиды при кристаллизации (рис. 248, 249), концентрируясь по границам зерен кристаллов [7]. Для того, чтобы оксид существовал в самостоятельной фазе, необходимо определенное давление кислорода, которое называют равновесным. В табл. 7 приведены численные значения равновесного давления кислорода над оксидами некоторых металлов.

Рис. 248. Диаграмма состояния

Рис. 249. Диаграмма состояния Ag-O2

Рис. 250. Пористость художественных отливок из нейзильбера до (а) и после (б) раскисления
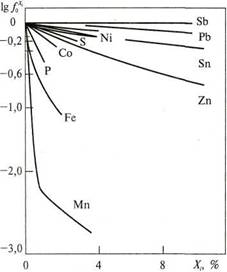
Рис. 251. Влияние компонентов [j]сплава на коэффициент активности кислорода в меди при 1150°С
Исключение составляет серебро, оксид которого устойчив ниже 190°С (рис. 249). Поэтому при кристаллизации сплавов на основе серебра, растворенный в них кислород выделяется при 940°С по газоэвтектической реакции: жидкий расплав → кристаллы + газ. По данным Э. Брсполя [4], одна часть, например, расплавленного серебра может растворить до 20 частей кислорода! При температуре, несколько меньшей температуры солидуса растворимость кислорода примерно в 40 раз меньше, чем в жидком растворе. Кислород, не успевший покинуть металлический расплав в процессе кристаллизации, образует газоусадочную пористость и раковины (рис. 250). При нагревании таких отливок газ в порах расширяется и на поверхности отливок возникает вспучивание (так называемое «дутое серебро»). Если сплав содержит медь, то она окисляется в первую очередь (в двойном сплаве Cu-Ag) с образованием закиси меди, 1% которой достаточно, чтобы сплав стал твердым и хрупким. Следовательно, расплавы медных сплавов необходимо обязательно раскислять (рис. 251).
Водород в расплавах меди является нежелательным элементом. С понижением температуры растворимость его уменьшается. При температуре плавления растворимость водорода составляет 6—8 см3 /100 г. Основным источником водорода являются пары воды в атмосфере печи, влага шихты, продукты сгорания в пламенных печах. На зеркале металла влага диссоциирует:
[Сu] + Н2О <=> [Сu] + 2[Н] + [О].
Предельную растворимость водорода в меди (см3/100 г) рассчитывают по соотношению

а для сплава

где j — компоненты сплава. Влияние компонентов расплава меди на растворимость водорода показано на рис. 252, а численные значения некоторых параметров взаимодействия первого порядка приведены ниже:
| Ni | Sn | Pb | Zn | Si | P | Al | |
| Содержание в сплаве, % не более | 4 | 3 | 10 | 5 | 3 | 1,8 | 12,5 |
| Параметр взаимодействия еjH | -0,026 | 0,016 | 0,03 | 0,012 | 0,042 | 0,088 | 0,046 |
Парциальное давление водорода в печи может изменяться в широких пределах, но для расчетов с достаточной точностью можно принять РН2 ~ РН2O.
По приведенным выше уравнениям рассчитывается равновесная растворимость водорода. Реальное количество водорода в расплаве может быть больше и меньше равновесного. Если плавку ведут на сырых шихтовых материалах в помещении с повышенной влажностью, то в расплаве содержание водорода может значительно превышать равновесное. Существует даже специальный термин «сезонный брак» (подкорковая пористость, увеличивающаяся осенью и весной, когда влажность воздуха повышается).
Равновесные водород и кислород взаимодействуют между собой. Из представленной зависимости (рис. 253), которая называется кривой Аллена, следует, что большая степень раскисленности расплава влечет за собой увеличение количества растворенного водорода, и наоборот. При постоянной температуре [%Н]3[%O]2 = 1,88 • 10-10 = const.

Рис. 252. Влияние компонентов [j]сплава на растворимость водорода в меди при 1150° С
В соответствии с этим медные расплавы раскисляют другими раскислителями. Например, при раскислении фосфористой медью (содержащей 8—12% Р)
[%Р]• [%О]3,5 = 2,5 • 10-10.

Рис. 253. Растворимость водорода и кислорода в меди
Общепринятой рекомендацией для раскисления является «дразнение» расплава осиновым поленом. Чтобы оно меньше обгорало, часто рекомендуют выдержать (вымочить) его в воде. По раскислительной способности древесный уголь, действительно, превосходит большинство твёрдых и жидких раскислителей. Но если он содержит влагу, то металл будет насыщен водородом.
Плавку в малых объемах в атмосфере воздуха необходимо вести под шлаком с прокаленным древесным углем или в графитовом тигле (часто шамотно-графитовом) в форсированном режиме, сокращая по возможности окислительный период плавки (на кондиционных или чистых материалах) и развивая восстановительный период.
Кроме газонасыщенности (мы рассмотрели только часть этого вопроса, не затронув условий образования пористости), к литейным свойствам сплавов относятся вязкость их расплавов, жидкотекучесть, усадка, трещиноустойчивость и склонность к образованию горячих трещин. Подробно они рассмотрены в специальной литературе, например [15, 16].
Из вышеприведенного следует, что выбор сплава для художественной отливки и условия его плавления для получения требуемых литейных и эксплуатационных свойств являются очень сложной задачей, которую часто решают без учета рассмотренных выше закономерностей и при этом иногда получают неплохие результаты. Однако опыт показывает, что качественная подготовка расплава — основа дальнейшего получения качественной отливки. Проиллюстрируем это на следующих примерах. На рис. 254 (см. вкладку) показана отливка «Паук», изготовленная по натуре. Сложность изготовления, кроме всего прочего, определяется выявлением мест подвода питателей. В данном случае металлический расплав подводили через лапки, которые закрепляли на прибыльной части. Определенную сложность вызывало удаление остатков хитинового покрова после прокалки формы и устранение деформации формы при прокалке перед заливкой и во время ее. Отливку после выбивки практически не подвергали обработке, кроме отделения от прибыли и удаления остатков формовочной массы. Никакой способ механической очистки в данном случае не может быть применен, так как это повредило бы волоски и шипы на хитиновом покрытии.
На рис. 255 (на вкладке) представлена отливка «Георгий Победоносец» (высота 45 мм). Сложность изготовления отливки связана с выбором ЛПС. Дело в том, что отливка не имеет внутренних опустошителей или стержней. Использовать холодильник в восковой модели в данном случае нецелесообразно. Из-за относительно быстрого остывания питателей подпитка тела коня затруднена. Развивающиеся при кристаллизации усадочные процессы могут привести к утяжинам на корпусе коня. Образование дефекта предупреждается выбором температур расплава и формы при заливке.

Рис. 256. Отливка «Серьги» диаметром 20 мм и толщиной 0,2 мм. Автор В. А. Васильев
На рис. 256 показаны серьги диаметром 20 и толщиной 0,2(!) мм, отлитые в гипсодинасовую форму. Основная сложность при этом — уменьшение деформации формы при прокаливании и заливке. Положительный эффект достигается выбором водно-массового отношения и термовременными режимами при прокаливании формы и заливке металлического расплава. Без использования достижений в области технологии литейных материалов получить подобные отливки невозможно.
 2020-06-08
2020-06-08 1717
1717








