Задание № 19 ЕГЭ посвящено классификации химических реакций, как неорганических, так и органических. Также потребуется вспомнить названия основных типов реакций.
По характеру процесса химические реакции в НЕОРГАНИЧЕСКОЙ ХИМИИ классифицируют на:
– реакции соединения: реакции типа
А + В = АВ
Это реакции, в которых из двух более простых веществ образуется одно более сложное, например:
С + О2 = СО2
2SO2 + О2 = 2SO3
CaO + H2O = Ca(ОН)2
– реакции разложения: реакции типа
АВ = А + В
Это реакции, в которых из одного более сложного вещества образуется несколько более простых, например:
2H2O2 = 2H2O + O2
Са(НСО3)2 = СаСО3 + СО2 + Н2О
– реакции обмена: реакции типа
АВ + CD = АD + ВC
Это реакции, в которых два сложных по строению вещества обмениваются своими частями, например:
BaCl2 + Na2SO4 = BaSO4 + 2NaCl
KOH + HNO3 = KNO3 + H2O
К реакциям обмена относятся реакции нейтрализации, гидролиза солей и т.п.
– реакции замещения: реакции типа
АВ + C = АC + В
В неорганической химии, реакции замещения – это обычно окислительно-восстановительные реакции между простым и сложным веществом, например:
Ni + CuSO4 = Cu + NiSO4
2КI + Cl2 → 2КCl + I2
К этому типу относятся реакции между металлом и раствором соли другого металла, металлов с водой, кислотами и др.
По характеру процесса химические реакции в ОРГАНИЧЕСКОЙ ХИМИИ классифицируют на:
– реакции замещения – взаимодействие двух веществ, при котором происходит замена одного атома (или группы атомов) в исходной молекуле, на другие атомы (или группы атомов). В реакциях замещения часть органической молекулы замещается на другие частицы, например:
СН4 + Cl2 = CH3Cl + HCl
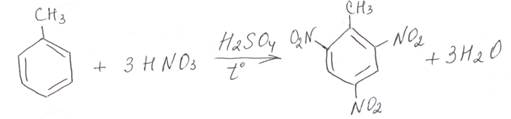
Н3С–СН2Cl + КОН водн. ® Н3С–СН2–ОН + КCl
В органической химии в реакцию замещения вступает основное сложное вещество и простое или сложное вещество, содержащее заместитель, в ходе реакции образуются два сложных вещества. Реакции замещения характерны для предельных и ароматических соединений.
– реакции присоединения – взаимодействие двух (или более) веществ с образованием одного вещества. Как правило, эти реакции – присоединение к основному органическому веществу небольшой молекулы другого вещества. Реакции присоединения характерны для непредельных соединений. Обычно реакции присоединения разделяют на:
реакции галогенирования – присоединение галогена, например:
Н2С=СН2 + Cl2 ® Н2ClС–СН2Cl
реакции гидрирования или гидрогенизации – присоединение Н2, например:
Н2С=СН2 + Н2 ® Н3С–СН3
реакции гидрогалогенирования – присоединение галогенводородов, например:
Н2С=СН2 + НCl ® Н3С–СН2Cl
реакции гидратации – присоединение воды, например:
Н2С=СН2 + Н2О ® Н3С–СН2–ОН
реакции полимеризации – соединение мономеров в полимеры, например:
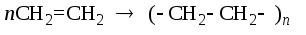
– реакции отщепления (элиминирования) – отрыв атомов или групп атомов от молекулы исходного вещества при сохранении ее углеродного скелета. К этому типу относятся реакции, обратные реакциям присоединения – дегидрирование (дегидрогенизация), дегидратация, дегидрогалогенирование, например:
Н3С–СН3 ® Н2С=СН2 + Н2
Н3С–СН2–ОН ® Н2С=СН2 + Н2О
Н3С–СН2Cl + КОН спирт. ® Н2С=СН2 + КCl + Н2О
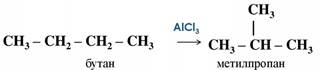
– реакции изомеризации или перегруппировки, например:
– реакции разложения – из молекулы сложного органического вещества образуется несколько менее сложных или простых веществ, например:
СН4 ® С + 2Н2
По изменению степени окисления химические реакции классифицируют на:
– окислительно-восстановительные – протекающие с изменением степеней окисления:
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl
– не окислительно-восстановительные – протекающие без изменения степеней окисления:
NH4Cl = NH3 + HCl
По возможности протекать в обратном направлении химические реакции классифицируют на:
– обратимые –это реакции, которые могут протекать как в прямом, так и в обратном направлении. Продукты реакции могут в данных условиях реакции реагировать между собой с образованием исходных веществ. Надо помнить, что к обратимым реакциям относятся:
гидролиз солей (кроме необратимого гидролиза);
реакции этерификации;
реакции образования сероводорода и галогенводородов (кроме HF):
 H2 + S H2S
H2 + S H2S
 H2 + Г2 2HГ
H2 + Г2 2HГ
реакции образования (разложения) карбоната кальция вЕГЭ считается обратимой (реально обратима эта реакция при высоких температурах):
 СаСО3 СаО + СО2
СаСО3 СаО + СО2
три реакции «главных химических синтезов ЕГЭ»:
 CO + 2H2 CH3OH
CO + 2H2 CH3OH
 3H2 + N2 NH3
3H2 + N2 NH3
 2SO2 + O2 2SO3
2SO2 + O2 2SO3
многие другие реакции между газами.
– необратимые –это реакции, которые протекают только в прямом направлении. Продукты реакции не могут в данных условиях взаимодействовать между собой. К необратимым реакциям относятся:
горение;
растворение металлов в воде, кислотах, щелочах;
обменные реакции в растворе, протекающие с образованием осадка, газа или воды и некоторые другие.
По тепловому эффекту химические реакции классифицируют на:
– экзотермические – идущие с выделением тепла. Надо помнить, что экзотермическими являются:
реакции горения (взаимодействия с кислородом угля, органических веществ, водорода);
большинство реакций образования сложных веществ из простых (единственное исключение, которое надо запомнить – образование NO из простых веществ – эндотермическая реакция);
три реакции «главных химических синтезов ЕГЭ»: синтез метанола, синтез аммиака, окисление SO2;
взаимодействие щелочных металлов с водой;
металлотермия и некоторые другие.
– эндотермические – идущие с поглощением тепла. Надо помнить, что эндотермическими являются:
большинство реакций разложения (например, разложение CaCO3);
реакции, идущие при высокой температуре или под действием электрического разряда (образование О3, NO, крекинг).
По наличию катализатора химические реакции классифицируют на:
– каталитические – для протекания реакции требуется присутствие катализатора. Катализатор – вещество, которое участвует в реакции, увеличивает скорость реакции, но в ее продукты не входит. Некоторые реакции в присутствии катализатора идут иначе, чем без него (см. разложение KClO3 и окисление NH3). Надо помнить, что к каталитическим относятся:
три реакции «главных химических синтезов ЕГЭ»: синтез метанола, синтез аммиака, окисление SO2;
многие органические реакции.
– некаталитические – протекают без участия катализатора. Это реакции:
– горения;
– реакции в растворе и др.
По агрегатному состоянию участвующих в реакции веществ химические реакции классифицируют на:
– гомогенные – это реакции между газами и реакции в растворе. В случае гомогенных реакций частицы реагирующих веществ могут сталкиваться во всем объеме реакционной смеси.
– гетерогенные – это реакции между веществами в разных агрегатных состояниях (между газом и твердым веществом, между газом и жидкостью, между жидкостью и твердым веществом), а также между твердыми веществами и между нерастворимыми друг в друге жидкостями. В случае гетерогенной реакции взаимодействие частиц может осуществляться только на поверхности раздела между веществами.
 2020-06-08
2020-06-08 112
112







