Тема урока «Уравнение Менделеева – Клапейрона. Уравнение Клапейрона»
-Изучите Опорный конспект,
-выпишите основные понятия в тетрадь
- решите задачи
После того, как все задания будут выполнены,
Сфотографируйте работу, сохраните документ под своей фамилией и отправьте
в ВК (https://vk.com/id16139670)
Ждем работы 09 апреля до 13.00
Параметры, характеризующие состояние идеального газа, и связь между ними.
Вспомните, что представляет собой идеальный газ.
Повторим: Давление (р)
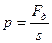 Единица измерения – Паскаль: 1 Па =1
Единица измерения – Паскаль: 1 Па =1 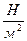 2. Давление газа обусловлено ударами молекул о стенки сосуда, в котором находится газ.
2. Давление газа обусловлено ударами молекул о стенки сосуда, в котором находится газ.
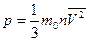 - основное уравнение молекулярно-кинетической теории
m0 – масса одной молекулы (в кг) (помнить: 1 а.е.м. = 1,66∙10-27 кг)
n – концентрация молекул (их число в 1м3 газа) - основное уравнение молекулярно-кинетической теории
m0 – масса одной молекулы (в кг) (помнить: 1 а.е.м. = 1,66∙10-27 кг)
n – концентрация молекул (их число в 1м3 газа)
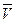 -средняя квадратичная скорость молекул (м/с)
Следствия из основного уравнения МКТ: -средняя квадратичная скорость молекул (м/с)
Следствия из основного уравнения МКТ:
 1). 1). 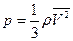 , где ρ – плотность 2). , где ρ – плотность 2). 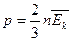 , где , где 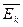 - средняя
газа, кг/м3 кинетическая энергия молекул газа - средняя
газа, кг/м3 кинетическая энергия молекул газа
| Температура (Т)
Энергетическая характеристика тела, определяет степень его нагретости. (t0 =00С cчитается нормальной при р норм. атмосферном)
Температура – мера средней кинетической энергии молекул газа.
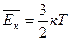 (соотношение получено опытным путем)
к – постоянная Больцмана, к = 1,38∙10-23 Дж/К
Т – абсолютная температура, измеренная по шкале Кельвина (К)
Т = t0(С) + 273 – связь между абсолютной температурой и температурой, измеренной по шкале Цельсия.
! Помните, что Δt0 = ΔТ; кроме того, (соотношение получено опытным путем)
к – постоянная Больцмана, к = 1,38∙10-23 Дж/К
Т – абсолютная температура, измеренная по шкале Кельвина (К)
Т = t0(С) + 273 – связь между абсолютной температурой и температурой, измеренной по шкале Цельсия.
! Помните, что Δt0 = ΔТ; кроме того, 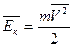 (из механики).
Тогда: (из механики).
Тогда: 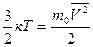 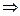 1. 1. 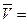 …(получите самостоятельно) …(получите самостоятельно)
|
Уравнение состояния идеального газа (Менделеева - Клапейрона)
Связывает давление р, объем V, абсолютную температуру Т.
Для данной массы m данного газа (М – его молярная масса) справедливо соотношение:
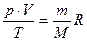 - уравнение Менделеева – Клапейрона., R – универсальная газовая постоянная, R = NA∙к = 8,31
- уравнение Менделеева – Клапейрона., R – универсальная газовая постоянная, R = NA∙к = 8,31 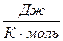
Т.о., для данной массы данного газа, как бы ни менялись его давление, объем, температура, соотношение 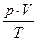 = const (уравнение Клапейрона)
= const (уравнение Клапейрона) 
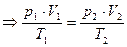
 2020-06-10
2020-06-10 106
106
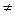 0, т.к.
0, т.к. 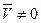 (иначе – противоречие с МКТ)
(иначе – противоречие с МКТ)






