Тема 16. Составление ОВР (задание 30)
В задании повышенной сложности по ОВР (№ 30) требуется составить ОВР из предложенного перечня веществ. Для этого нужно хорошо ориентироваться в окислительно-восстановительных свойствах элементов, знать типичные окислители и восстановители.
Напомним общие правила.
1. В периоде с повышением порядкового номера восстановительные свойства простых веществ снижаются, а окислительные – возрастают и становятся максимальными у галогенов. Вниз по группе восстановительные свойства усиливаются (Приложение А).
2. В соединениях окислительно-восстановительные свойства зависят от степени окисления атома в данном соединении: например, азот в NH3 имеет минимальную степень окисления –3 и может проявлять только свойства восстановителя; в NО имеет промежуточную степень окисления +2, он может проявлять как свойства окислителя, так и восстановителя; в KNO3 азот имеет максимальную степень окисления +5, он может проявлять только свойства окислителя.
3. Изменение степени окисления (количество отданных и принятых электронов), может зависеть от условий реакции: температуры, среды в растворе (кислой, нейтральной, щелочной).
Рассмотрим важнейшие окислители и восстановители (таблица 2), под таблицей подробно разберем их свойства и примеры реакций.
Таблица 2 – Окислители и восстановители
| Восстановители | Окислители |
| 1. Металлы – простые вещества: Me0 – n ē ® Me+ n | 1. Ионы металлов: а) могут восстанавливаться до металлов Me+ n + n ē ® Me0 б) или переходить в низкую степень окисления (это характерно для Fe+3, Pb+4, Cu+2 и др.) Me+ n + m ē ® Me+(n – m)
|
| 2. Ионы металлов в низкой степени окисления: Me+ n – m ē ® Me+(n+ m) | |
| 3. Неметаллы – простые вещества, при взаимодействии с более электроотрицательными неметаллами: Э0 – n ē ® Э+ n | 2. Неметаллы – простые вещества, при взаимодействии с металлами и с менее электроотрицательными неметаллами: Э0 + n ē ® Э– n |
| 4. Соединения, содержащие неметаллы в низкой степени окисления, например: а) угарный газ CO C+2 – 2 ē = C+4 б) соединения азота, содержащие азот в степени окисления –3 (аммиак NH3 и нитриды), +1, +2, (оксиды азота) +3 (нитриты) – до более устойчивых степеней окисления 0, +4, +5: 2N–3 – 6 ē = N02 N+2 – 2 ē = N+4 N+3 – 2 ē = N+5 в) соединения фосфора, содержащие фосфор в степени окисления –3 (фосфин PH3 и фосфиды) и +3 (оксид фосфора (III) P2O3 и фосфиты): P–3 – 8 ē = P+5 P+3 – 2 ē = P+5 г) пероксид водорода H2O2 и пероксиды в реакции с окислителями 2O–1 – 2ē = O02 | 3. Группа типичных сильных окислителей – соли кислород-содержащих кислот, а также соответствующие им оксиды, например: а) соединения Mn+7: KMnO4, HMnO4, NaMnO4: в кислой среде Mn+7 + 5 ē ® Mn+2 в нейтральной среде Mn+7+3ē = Mn+4(MnO2¯) в щелочной среде Mn+7 + 1 ē = Mn+6 MnO2, K2MnO4 – могут быть и окислителями, и восстановителями б) соединения хрома +6: K2Cr2O7, K2CrO4, CrO3: Cr+6 + 3 ē = Cr+3 в кислой среде образуются соли хрома – зеленый р-р; в нейтральной среде – зеленый осадок Cr(OН)3; в щелочной среде образуются комплексные ионы [Cr(OН)6]3– в) кислородсодержащие кислоты галогенов и их соли: ГОх– + n ē ® Г– (реже Г2) + [O] |
| д) соединения серы, содержащие серу в степени окисления –2 (H2S и сульфиды) и +4 (SO2 и сульфиты): S–2 – 2 ē = S0 или S–2 – 6 ē = S+4 S+4 – 2 ē = S+6 e) галогенводородные кислоты (кроме HF) и их соли 2Г– – 2 ē ® Г2 или Г– – n ē ® Г n –1 | 4. Концентрированная серная кислота – окислитель за счет S+6: H2SO4(конц.)+Me®MeSO4+H2O+{H2SилиSилиSO2} H2SO4(конц.)+ неMe, сл. в-ва ®…+{ S или SO2} |
| 5. Азотная кислота – сильный окислитель за счет N+5: HNO3(разб.)+Me(Li–Mg)®Me(NO3) n +H2O+NH4NO3 HNO3(конц.)+Me(Li–Mg)®Me(NO3) n +H2O+N2O HNO3(разб.)+Me(Al–Cu)®Me(NO3) n +H2O+NO HNO3(конц.)+Me(Al–Cu)®Me(NO3) n +H2O+NO2 HNO3 + неMe, сложные в-ва ® …+ NO2 Нитраты проявляют окислительные свойства только с сильными восстановителями. | |
| 5. Альдегиды, спирты, непредельные углеводороды и др. органические вещества | 6. Кислород в степени окисления 0 и –1: газы кислород и озон, пероксиды: О2 + 4 ē = 2О2– О3 + 2 ē = О2–+ О2 О– + ē = О2– |
Восстановители
1. Металлы.
Все металлы (простые вещества) – восстановители, вступая в реакцию, они теряют электроны:
Me0 – n ē ® Me+ n
Все металлы в соединениях проявляют только положительную степень окисления. Некоторые металлы (Fe, Cr, Mn и др.) могут перейти в разные степени окисления (например, +2, +3, +6), в зависимости от окислителя.
Восстановительная способность (активность) металлов различная. Ее можно оценить по положению металла в ряду активности (см. Приложение Б). Для удобства разделим металлы на три группы:
– до Mg включительно – очень активные;
– от Mg до водорода – средней активности;
– после водорода – малоактивные.
Рассмотрим важнейшие свойства металлов.
А) Взаимодействие с неметаллами – O2, H2, Cl2, S, N2, P, C и т.д., например:
4Al + 3O2 = 2Al2O3
4Cr + 3O2 = 2Cr2O3
3Fe + 2O2 = Fe+2Fe+32O4
2Na + O2 = Na2O2
Ba + H2 = BaH2
Fe + S = FeS
2Fe + 3Cl2 = 2FeCl3
3Ba + 2P = Ba3P2
4Al + 3C = Al4C3
Б) Взаимодействие с водой.
Очень активные металлы реагируют с водой (магний реагирует при нагревании, алюминий – после удаления оксидной пленки). Эту реакцию можно выразить общей схемой:
Me + H2O ® Me(OH) n + H2
например:
2Na + 2H2O = 2NaOH + H2
Металлы средней активности в обычных условиях с водой не реагируют (или реагируют с очень малой скоростью – например, железо ржавеет). Но при повышенной температуре идет реакция с водяным паром:
Me + H2O (газ) 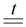 Me2O n + H2
Me2O n + H2
например:
3Fe + 4H2O (газ) 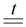 Fe+2Fe+32O4 + 4H2
Fe+2Fe+32O4 + 4H2
Zn + H2O (газ) 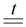 ZnO + H2
ZnO + H2
Малоактивные металлы с водой не реагируют.
В) Взаимодействие со щелочами – реагируют металлы, образующие амфотерные оксиды и гидроксиды (см. тему 5).
Г) Более активные металлы вытесняют менее активные из их оксидов и солей.
Д) С кислотами-неокислителями реагируют металлы, стоящие в ряду активности до водорода (см. тему 5). Эти реакции можно выразить общей схемой:
Me0 + 2H+ ® Me+ n + H02
Окислителем являются ионы водорода, выделяется газ водород.
Здесь рассмотрим взаимодействие металлов с кислотами-окислителями: азотной и концентрированной серной кислотой.
Азотная кислота растворяет практически все металлы, кроме золота и платины.
Следует помнить, что железо, алюминий и хром пассивируются холодной концентрированной азотной кислотой. При нагревании эти металлы растворяются.
Окислителем является азот в степени окисления +5. Газ водород не выделяется! Продукты реакции зависят от концентрации кислоты и активности металла – чем более активен металл и разбавленнее кислота, тем в большей степени восстанавливается азот. Для решения заданий ЕГЭ рекомендуется пользоваться схемой на рисунке 1.
Например:
4Ca + 10HNO3 (очень разб.) = NH4NO3 + 4Ca(NO3)2 + 3H2O
4Mg + 10HNO3 (разб.) = N2O + 4Mg(NO3)2 + 5H2O
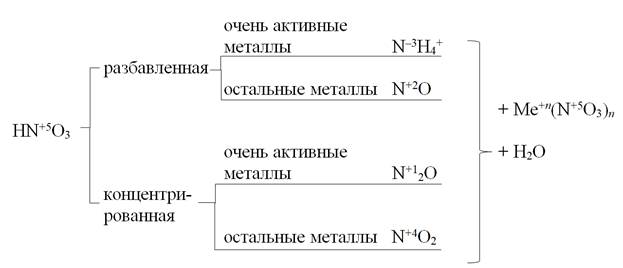
Рисунок 1 – Взаимодействие азотной кислоты с металлами
Fe + 4HNO3 (разб.) = NO + Fe(NO3)3 + 2H2O
Al + 4HNO3 (конц.) 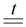 NO + Al(NO3)3 + 2H2O
NO + Al(NO3)3 + 2H2O
Cu + 4HNO3 (конц.) = 2NO2 + Cu(NO3)2 + 2H2O
Еще более активна азотная кислота в смеси с концентрированной соляной – этот реактив называется царской водкой. В этой смеси растворяются даже золото и платина:
HNO3 (конц.) + 4HCl (конц.) + Au = H[AuCl4] + NO + 2H2O
4HNO3 (конц.) + 18HCl (конц.) + 3Pt = 3H2[PtCl6] + 4NO + 8H2O
Концентрированная серная кислота, в отличие от разбавленной, является окислителем за счет серы в степени окисления +6. В ней могут растворяться металлы, стоящие в ряду активности до серебра включительно.
Следует помнить, что железо, алюминий и хром пассивируются холодной концентрированной серной кислотой. При нагревании эти металлы растворяются.
При взаимодействии концентрированной серной кислоты с металлами газ водород не выделяется. Продукт реакции зависит от активности металла:
очень активные металлы и цинк – H2S
металлы средней активности – S
малоактивные – SO2
Общее уравнение:
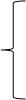 H2S
H2S
или
Me + H2SO4 (конц.) ® MeSO4 + H2O + S
или
SO2
Например:
4Zn + 5H2SO4 (конц.) = 4ZnSO4 + H2S + 4H2O
3Mn + 4H2SO4 (конц.) = 3MnSO4 + S + 4H2O
2Ag + 2H2SO4 (конц.) = Ag2SO4 + SO2 + 2H2O
Следует учитывать, что продукты реакции могут сами окисляется H2SO4 (конц.):
3H2S + H2SO4 (конц.) = 4S + 4H2O
S + 2H2SO4 (конц.) = 3SO2 + 2H2O
Обычно образуется смесь продуктов, например светло-желтый осадок S и газ SO2. В тестовых заданиях ЕГЭ указывается один продукт восстановления серы, в заданиях повышенной сложности (если нет подсказки по внешним признакам реакции) допускается выбрать любой подходящий продукт – например, при растворении алюминия в горячей концентрированной серной кислоте можно привести одну из реакций:
8Al + 15H2SO4 (конц.) 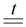 4Al2(SO4)3 + 3H2S + 12H2O
4Al2(SO4)3 + 3H2S + 12H2O
2Al + 4H2SO4 (конц.) 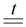 Al2(SO4)3 + S + 4H2O
Al2(SO4)3 + S + 4H2O
2. Ионы металлов в низкой степени окисления могут проявлять восстановительные свойства, если у данного метала несколько степеней окисления:
Me+ n – m ē ® Me+( n+ m)
Ионы Fe+2, Cr+2, Cr+3, Mn+2, Mn+4, Sn+2 и некоторые другие – типичные восстановители, приведем примеры реакций:
Fe+2O + 4HN+5O3 (конц.) = Fe+3(N+5O3)3 + N+4O2 + 2H2O
6Fe+2SO4+K2Cr+62O7 (конц.)+7H2SO4 = 3Fe+32(SO4)3+Cr+32(SO4)3+K2SO4+7H2O
6Fe+2SO4+2KMnO4 (конц.) +4H2O = 2Fe+3(OH)3 + 2Fe+3OHSO4 + Fe+32(SO4)3 + + 2MnO2¯ + K2SO4
Cr+2Cl2 + 4HN+5O3 = Cr+3(N+5O3)3 + 2HCl + N+4O2 +H2O
2Cr+3Cl3 + KCl+5O3 + 10KOH = 2K2Cr+6O4 + 7KCl– + 5H2O
3Mn+2O + 2KCl+5O3 + 6KOH = 3K2Mn+6O4 + 2KCl– + 3H2O
3Mn+2SO4 + 2KMn+7O4 (конц.) + 2H2O = 5Mn+4O2¯ + K2SO4 + 2H2SO4
2Mn+4O2 + 3Cl02 + 8KOH = 2KMn+7O4 + 6KCl– + 4H2O
2Mn+4O2 + O02 + 4KOH = 2K2Mn+6O–24 + 2H2O–2
3. Неметаллы – простые вещества, в реакциях с более электроотрицательными неметаллами окисляются:
Э0 – n ē ® Э+ n
Почти все неметаллы могут реагировать с фтором, кислородом, хлором:
S + 3F2 = SF6
2H2 + O2 = 2H2O
C + O2 = CO2
степень окисления часто зависит от количества окислителя, например:
2P + 3Cl2 = 2PCl3
2P + 5Cl2 (изб.) = 2PCl5
Неметаллы – простые вещества окисляются и многими сложными веществами, (см. также раздел «Окислители» данного пособия).
4. Соединения, содержащие неметаллы в низкой степени окисления, например
а) угарный газ CO – при высокой температуре очень сильный восстановитель:
3C+2O + Fe+32O3 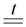 2Fe0 + 3C+4O2
2Fe0 + 3C+4O2
2C+2O + O02 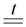 2C+4O–22
2C+4O–22
C+2O + Cl02 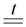 C+4OCl–2
C+4OCl–2
б) соединения азота, содержащие азот в степени окисления –3 (аммиак NH3 и нитриды), +1, +2, (оксиды азота) +3 (нитриты).
Аммиак, амины, нитриды содержат азот в низшей степени окисления и могут проявлять только восстановительные свойства. Обычно образуется газ азот, например:
2NH3 + 3CuO = 3Cu + N2 + 3H2O
4CH2(NH2)–COOH (глицин) + 9O2 = 8CO2 + 10H2O + 2N2
(NH4)2Cr2O7 = Сr2O3 + N2 + 4H2O
Оксиды азота N2O, NO содержат азот в промежуточной степени окисления, а значит, могут проявлять и восстановительные и окислительные свойства. N2O и слабый окислитель, и слабый восстановитель. NO проявляет окислительные свойства с сильными восстановителями, например:
2NO + 2H2 = N2 + 2H2O
Чаще – NO восстановитель, например он легко окисляется на воздухе до бурого газа NO2:
2NO + О2 = 2NO2
Азотистая кислота, оксид азота (III) и нитриты содержат азот в промежуточной степени окисления +3 и могут проявлять и восстановительные и окислительные свойства. При взаимодействии с сильными восстановителями азот восстанавливается, например:
2HNO2 + 2HI = I2 + 2NO + 2H2O
NH4NO2 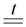 N2 + 2H2O
N2 + 2H2O
2KNO2 + 2H2SO4 + 2FeSO4 = 2NO + Fe2(SO4)3 + K2SO4 + 2H2O
Но в большинстве случаев N+3 окисляется до N+5. Следует запомнить, что нитриты (KNO2, NaNO2) – сильные восстановители, из нитритов образуются нитраты, в ЕГЭ много реакций с их участием, например:
KNO2 + Cl02 + H2O = KNO3 + 2HCl
3KNO2 + K2Cr2O7 + 4H2SO4 = 3KNO3 + Cr2(SO4)3 + 4H2O + K2SO4
5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + 3H2O + K2SO4
в) соединения фосфора, содержащие фосфор в степени окисления –3 (фосфин PH3 и фосфиды) и +3 (оксид фосфора (III) P2O3 и фосфиты) – сильные восстановители. Фосфор окисляется до стабильной степени окисления +5:
P–3 –8 ē = P+5
P+3 –2 ē = P+5
образуются фосфорные кислоты (H3PO4, HPO3) или их соли. В ЕГЭ много заданий на окислительно-восстановительные свойства соединений фосфора. Также встречаются реакции с соединениями мышьяка – они подобны соединениям фосфора в ОВР. Приведем примеры реакций:
Mg3P2 + 22HNO3 = 3Mg(NO3)2 + 2H3PO4 + 16NO2 + 8H2O
5PH3 + 8HBrO3 = 5H3PO4 + 4Br2 + 4H2O
3P2O3 + 4HNO3 + 7H2O = 6H3PO4 + 4NO
3PCl3 + 8HNO3 + 2H2O = 3H3PO4 + 8NO + 9HCl
As2O3 + 2I2 + 5H2O = 2H3AsO4 + 4HI
г) пероксид водорода H2O2 и пероксиды содержат кислород в промежуточной неустойчивой степени окисления –1. Говорят, что пероксид водорода проявляет так называемую окислительно-восстановительную двойственность. Чаще H2O2 – окислитель, но в реакции с сильными окислителями проявляет восстановительные свойства, например:
H2O2 + Cl02 = O2 + 2HCl
5H2O2 + 2KMnO4 + 3H2SO4 = 2MnSO4 + 5O2 +K2SO4 + 8H2O
Под действием света или катализатора пероксид водорода диспропорционирует:
2H2O2 = O2 + 2H2O
д) соединения серы, содержащие серу в степени окисления –2 и +4.
Сероводород H2S и сульфиды (гидросульфиды) содержат серу в низшей степени окисления –2 и могут проявлять только восстановительные свойства. Без нагревания с не очень сильными окислителями образуется элементарная сера:
S–2 –2 ē = S0
При нагревании, или с очень сильными окислителями, образуется диоксид серы (сульфиты):
S–2 –2 ē = S+4
В избытке окислителя окисление может пойти и дальше – до S+6 (до сульфатов).
Приведем примеры окисления сероводорода и сульфидов:
2H2S + O2 = 2S + 2H2O
2H2S + 3O2 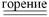 2SO2 + 2H2O
2SO2 + 2H2O
BaS + 2O2 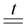 BaSO4
BaSO4
H2S + H2SO4 (конц.) = S¯ + SO2 + 2H2O
H2S + 3H2SO4 (конц.) 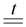 4SO2 + 4H2O
4SO2 + 4H2O
Na2S + 3H2SO4 (конц.) = 2NaHSO4 + S¯ + SO2 + 2H2O
H2S + 8HNO3 (конц.) 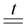 H2SO4 + 8NO2 + 4H2O
H2SO4 + 8NO2 + 4H2O
Na2S + 4HNO3 (конц.) = 2NaNO3 + 2NO2 + S¯ + 2H2O
H2S + HMnO4 = S¯ + MnO2¯ + H2O
Вещество, в которое переходит сера, определяется многими факторами. В ЕГЭ часто в условии задачи приводится описание продукта реакции: желтый осадок – сера, газ с резким запахом – диоксид серы. Если это описание отсутствует, допускается выбрать любое подходящее вещество.
Диоксид серы SO2 и сульфиты (гидросульфиты) содержат серу в промежуточной степени окисления +4 и могут проявлять и окислительные и восстановительные свойства.
Окислительные свойства выражены слабо, проявляются только с сильными восстановителями, например:
2H2S + SO2 = 3S + 2H2O
Следует запомнить, что SO2 и сульфиты (Na2SO3, K2SO3) – типичные восстановители, S+4 легко переходит в S+6:
S+4 –2 ē = S+6
образуется газ SO3 (H2SO4) или сульфаты, например:
2SO2 + O2 + 2H2O = 2H2SO4
SO2 + 2HNO3 (конц.) = H2SO4 + 2NO2
5SO2 + 2HMnO4 + 2H2O = 3H2SO4 + 2MnSO4
Na2SO3 + 2KOH + 2KMnO4 = Na2SO4 + 2K2MnO4 + H2O
3Na2SO3 + 4H2SO4 + K2Cr2O7 = 3Na2SO4 + Cr2(SO4)3 + 4H2O + K2SO4
K2SO3 + 2HNO3 (конц.) = K2SO4 + 2NO2 + H2O
10KHSO3 + 4KMnO4 + H2SO4 = 7K2SO4 + 4MnSO4 + 6H2O
е) галогеноводородные кислоты и их соли (кроме HF и фторидов).
Восстановительная способность увеличивается в ряду HCl ®HBr ®HI.
Ион Cl– можно окислить только очень сильными окислителями, образуется газ хлор:
16HCl– + 2KMn+7O4 = 5Cl02 + 2Mn+2Cl2 + 2KCl + 8H2O
14HCl– + K2Cr+62O7 = 3Cl02 + 2Cr+3Cl3 + 2KCl + 7H2O
4HCl– + Pb+4O2 = Cl02 + Pb+2Cl2 + 2H2O
2HCl– + F02 = 2HF– + Cl02
Окислительная способность галогенов (простых веществ) снижается в ряду F2 ® Cl2 ® Br2 ® I2, поэтому каждый предыдущий элемент вытесняет последующий из галогенводородных кислот и их солей, например:
2HCl + F2 = 2HF + Cl2
2HBr + Cl2 = 2HCl + Br2
2KI + Br2 = 2KBr + I2
5. Органические вещества.
Альдегиды, спирты, непредельные углеводороды, муравьиная и щавелевая кислота, гомологи бензола и некоторые другие органические вещества способны не только гореть на воздухе, но и окислятся многими окислителями: KMnO4, K2Cr2O7, CuO, Cu2O, Ag2O и др.
Окислители
1. Ионы металлов.
А) Ионы менее активных металлов восстанавливаются более активными металлами – простыми веществами.
Реакция возможна между активным металлом и оксидом или солью менее активного металла при высокой температуре (это один из методов получения металлов – металлотермия), например:
2Al + Cr2О3 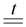 Al2О3 + 2Cr
Al2О3 + 2Cr
2Mg + TiCl4 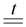 Ti + 2MgCl2
Ti + 2MgCl2
или при обычной температуре между активным металлом и раствором соли менее активного металла, например:
Zn + NiSO4 = Ni + ZnSO4
2Al + 3CuCl2 = 3Cu + 2AlCl3
Б) Если у металла несколько степеней окисления, то ион металла в может восстановится до ближайшей меньшей, а не до металла. Это характерно для солей и оксидов Fe+3, Pb+4, Cu+2 и др.
Следует запомнить, что соли железа(III) сильные окислители, причем железо восстанавливается не до металлического железа, а до Fe+2. Например, в растворе FeCl3 можно растворить медь, ртуть и само железо:
2FeCl3 + Cu = 2FeCl2 + CuCl2
2FeCl3 + 2Hg = 2FeCl2 + Hg2Cl2
2FeCl3 + Fe = 3FeCl2
В реакции нейтрализации между гидроксидом железа(III) и йодоводородной кислотой образуется йодид железа(II):
2Fe(OH)3 + 6HI = 2FeI2 + I2 + 6H2O
Рассмотрим другие реакции с участием ионов металлов в высокой степени окисления:
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl
2FeCl3 + 3Na2S = 2FeS¯ + S¯ + 6NaCl
2CuSO4 + 4KI = 2CuI + I2 + 2K2SO4
Pb+4O2 + S+4O2 = Pb+2S+6O4
Pb+4O2 + 4HCl = Pb+2Cl2¯ + Cl2 + 2H2O
3. Неметаллы – простые вещества, при взаимодействии с металлами и с менее электроотрицательными неметаллами, например:
S + Ca 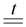 CaS
CaS
H2 + 2Na = 2NaH
Cl2 + S = SCl2
4. Группа типичных сильных окислителей – соли кислородсодержащих кислот, а также соответствующие им оксиды.
а) соединения Mn+7: KMnO4, HMnO4, NaMnO4 – самый популярный окислитель. Ион MnO4– фиолетового цвета, при восстановлении окраска меняется – по этому признаку определяют присутствие в растворе восстановителя. Цвет определяется средой: чем меньше pH, тем больше восстанавливается марганец.
В кислой среде образуются бесцветные ионы Mn+2:
Mn+7 + 5 ē = Mn+2
в нейтральной среде марганец восстанавливается до степени окисления +4 и выделяется в виде бурого осадка MnO2:
Mn+7 + 3 ē = Mn+4
в щелочной среде фиолетовый перманганат ион MnO4– переходит в зеленый манганат-ион MnO4–2:
Mn+7 + 1 ē = Mn+6
Приведем примеры реакций:
2HMnO4 + 14HCl (конц.) = 2MnCl2 + 5Cl2 + 8H2O
2NaMnO4 (разб.) + 3Н2 = 2MnO2¯ + 2NaOH + 2H2O
8KMnO4 + 8KOH + KI = 8K2MnO4 + KIO4 + 4H2O
MnO2, K2MnO4 содержат марганец в промежуточных степенях окисления и могут проявлять как окислительные, так и восстановительные свойства, например:
K2MnO4 + C2H5OH = MnO2¯ + CH3CHO + 2KOH
2K2MnO4 + Cl2 = 2KMnO4 + 2KCl
MnO2 + 2H2SO4 + 2FeSO4 = MnSO4 + Fe2(SO4)3 + 2H2O
MnO2 + KNO3 + 2KOH = K2MnO4 + KNO2 + H2O
б) соединения Cr+6: K2Cr2O7, K2CrO4, CrO3 – очень сильные окислители. Обычно хром восстанавливается до степени окисления +3:
Cr+6 + 3 ē = Cr+3
В кислой среде образуются соли хрома – зеленый раствор; в нейтральной среде – зеленый осадок Cr(OН)3; в щелочной среде образуются комплексные ионы [Cr(OН)6]3–. Примеры реакций:
K2Cr2O7 + 4H2SO4 + 3KNO2 = Cr2(SO4)3 + 3KNO3 + 4H2O + K2SO4
2CrO3 + 3H2S = 2Cr(OH)3¯ + 3S¯
2K2CrO4 + 3K2SO3 + 2KOH + 5H2O = 2K3[Cr(OH)6] + 3K2SO4
в) кислородсодержащие кислоты галогенов и их соли (гипохлориты, хлориты, хлораты, перхлораты и аналогичные соединения брома и йода) являются популярными окислителями. В большинстве случаев восстанавливаются до галогенид-иона:
Г+ n + (n +1) ē = Г–
реже – до простого вещества галогена:
2Г+ n + 2 n ē = Г2
Следует запомнить, что в ЕГЭ часто встречается популярный окислитель хлорат калия KClО3 (бертолетова соль).
Приведем примеры реакций:
KClО3 + 6HI = KCl + 3I2 + 3H2O
2HClO3 + 3P2O3 + 9H2O = 2HCl + 6H3PO4
KBrO4 + 4H2S = KBr + 4S + 4H2O
5KIO4 + 2MnSO4 + 3H2O = 2HMnO4 + 4KIO3 + 2H2SO4
5. Концентрированная серная кислота – окислитель за счет серы в степени окисления +6. Разбавленная же серная кислота проявляет слабые окислительные свойства за счет восстановления Н+. Например, в разбавленной кислоте растворяются металлы, стоящие в ряду активности до водорода (Приложение Б), по схеме:
H2SO4 (разб.) + Me ® MeSO4 + H2
В концентрированной же серной кислоте растворяются металлы, стоящие в ряду активности до меди включительно. Взаимодействие идет по схеме:
H2SO4 (конц.) + Me ® MeSO4 + H2O + {H2S или S или SO2}
подробно см. на стр. 30 данного учебного пособия. Поэтому в реакциях, с участием серной кислоты обязательно указывают, концентрированная кислота (т.е. 92–96 %, товарная, не разбавленная водой) – обозначается обычно (конц.), или разбавленная водой (иногда говорят раствор серной кислоты) – обозначается (разб.) или (р-р).
Концентрированная серная кислота окисляет и многие неметаллы, а также многие сложные вещества, которые могут проявлять восстановительные свойства. Приведем примеры реакций:
2H2SO4 (конц.) + C = СО2 + 2H2O + 2SO2
3H2SO4 (конц.) + 2KBr = SO2 + Br2 + 2H2O + 2KHSO4
2H2SO4 (конц.) + S 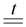 3SO2 + 2H2O
3SO2 + 2H2O
Обратим внимание на взаимодействие H2SO4 (конц.) с серой – эта реакция идет при нагревании, в холодных растворах кислоты часто образуется сера в виде светлого осадка, например
3Ni + 4H2SO4 (конц.) = 3NiSO4 + S¯ + 4H2O
H2SO4 (конц.) + H2S = SO2 + S¯ + 2H2O
6. Азотная кислота – сильный окислитель за счет азота в степени окисления +5. Взаимодействие HNO3 с металлами подробно рассмотрено на стр. 28 данного учебного пособия. Следует запомнить, что продукт восстановления азота зависит и от активности металла и от концентрации кислоты.
Азотная кислота (особенно концентрированная) реагирует со многими неметаллами: углеродом, серой, фосфором, из галогенов – с фтором и йодом; в этих реакциях обычно выделяется бурый газ NO2:
4HNO3 + C = 4NO2 + CO2 + 2H2O
6HNO3 + S = 6NO2 + H2SO4 + 2H2O
6HNO3 + P = 6NO2 + H3PO4 + 2H2O
10HNO3 + I2 = 10NO2 + 2HIO3 + 4H2O
Азотная кислота окисляет и многие сложные вещества, которые могут проявлять восстановительные свойства. Продукт восстановления азота – также NO2:
8HNO3 + CuS = 8NO2 + CuSO4 + 4H2O
12HNO3 + FeS = 9NO2 + Fe(NO3)3 + H2SO4 + 5H2O
4HNO3 + As2O3 + H2O = 4NO2 + 2H3AsO4
6HNO3 + HI = 6NO2 + HIO3 + 3H2O
4HNO3 + CrCl2 ® NO2 + Cr(NO3)3 + 2HCl + H2O
2HNO3 + SO2 = 2NO2 + H2SO4
2HNO3 (хол.) + H2S = 2NO2 + S¯ + 2H2O
Нитраты проявляют окислительные свойства только с сильными восстановителями, например:
KNO3 + 4Mg + 6H2O = NH3 + 4Mg(OH)2 + KOH
7. Кислород в степени окисления 0 и –1: газы кислород и озон, пероксиды – сильные окислители:
О2 + 4 ē = 2О2–
О3 + 2 ē = О2–+ О2
О– + ē = О2–
Ион входит О2– в состав молекул H2O, ионов OH–.
Кислород – сильный окислитель, реагирует с большинством металлов и неметаллов, окисляет многие неорганические и все органические соединения:
O2 + Zn = 2ZnO
O2 + C = CO2
11O2 + 4FeS2 = 2Fe2O3 + 8SO2
O2 + 4Cr(OH)2 + 2H2O = 4Cr(OH)3
2O2 + CH4 = CO2 + 2H2O
Озон еще более сильный окислитель, чем кислород, приведем примеры реакций:
O3 + Mn(NO3)2 + H2O = MnO2¯ + O2 + 2HNO3
O3 + H2S = SO2 + H2O
O3 + NO = NO2 + O2
Последние две реакции – причина разрушения озонового слоя Земли.
Пероксид водорода H2O2 и пероксиды проявляют так называемую окислительно-восстановительную двойственность. Окислительные свойства выражены в большей степени:
H2O2 + Na2SO3 = Na2SO4 + H2O
3H2O2 + 2Na3[Cr(OH)6] = 2Na2CrO4 + 8H2O + 2NaOH
4H2O2 + PbS (черный) = PbSO4 (белый) + 4H2O
Уравнивание ОВР методом электронного баланса (задание 30)
В задании повышенной сложности по ОВР требуется написать реакцию, составить электронный баланс, указать окислитель и восстановитель, уравнять реакцию.
В школьной программе и ЕГЭ определение коэффициентов ОВР осуществляется методом электронного баланса. Рассмотрим его на примере реакции:
KMnO4 + HCl ® Cl2 + MnCl2 + KCl + H2O
Чтобы определить окислитель и восстановитель, расставим степени окисления над каждым элементом:
K+Mn+7O–24 + H+Cl– ® Cl02 + Mn+2Cl–2 + K+Cl– + H+2O–2
Марганец понижает свою степень окисления, Mn+7 и в целом KMnO4 – окислитель. Хлор повышает свою степень окисления, Cl– и в целом HCl – восстановитель. Обратим внимание, что изменяет степень окисления только часть ионов Cl–.
Реакция осуществляется за счет перехода электронов от восстановителя (Cl–) к окислителю (Mn+7). Mn+7 принимает 5 электронов и переходит в Mn+2, каждый ион Cl– теряет электрон и переходит в Cl0. Эти процессы принято выражать т. н. электронными уравнениями:
Mn+7 + 5 ē = Mn+2
2Cl– – 2 ē = Cl02
Обратим внимание, что если в реакции участвует простое вещество в виде двухатомных молекул (Cl02, О02, Н02, I02 и т.п.), в электронных уравнениях его обязательно следует записывать в виде молекул. Это правило облегчает дальнейший подбор коэффициентов.
В уравненной реакции число отданных электронов должно равняться числу принятых. Подбираем наименьшее общее кратное числа электронов, переданных в каждом электроном уравнении: в нашем примере это 10. Т.е. первое электронное уравнение нужно умножить на 2, второе – на 5:
2´½Mn+7 + 5 ē = Mn+2
5´½2Cl– – 2 ē = Cl02
Полученная система уравнений и называется электронный баланс: 2 иона Mn+7 принимают 10 электронов и превращаются в Mn+2, от 10 ионов Cl– отдают те же 10 электронов и переходят в 5 молекул Cl02. Таким образом, мы получили основные коэффициенты реакции, перенесем их в уравнение (коэффициент перед HCl пока не ставим – часть ионов Cl– не изменила степень окисления):
2K+Mn+7O–24 + H+Cl– ® 5Cl02 + 2Mn+2Cl–2 + K+Cl– + H+2O–2
Оставшиеся коэффициенты подбираем: уравниваем K+, затем Cl–, H+, O–2:
2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O
Окончательно поверяем – число атомов каждого элемента слева и справа должно быть одинаковым.
Рассмотрим еще один пример выполнения задания на составление электронного баланса (без пояснений):
Пример 5. Для реакции
P + HClO3 + H2O ® H3PO4 + HCl
составьте электронный баланс, укажите окислитель и восстановитель.
Решение.
6P + 5HClO3 + 9H2O = 6H3PO4 + 5HCl
6´½P0 – 5 ē = P+5
5´½Cl+5 + 6 ē = Cl–
P – фосфор в степени окисления 0 является восстановителем, HClO3, а точнее хлор в степени окисления +5 является окислителем.
 2020-06-10
2020-06-10 99
99







