Введение
Известно, что растения поражаются различными вирусами и возбудителями болезней, подвергаются негативному воздействию вредных организмов в процессе их жизнедеятельности.
В результате большая часть сил зараженного растения уходит на борьбу с патогенами, у него нарушается обмен веществ, снижается продуктивность, уменьшается количество цветоносов и число ягод на них, сами ягоды мельчают, затягивается их созревание, ухудшается устойчивость к другим болезням и вредителям.
Значительно понижаются количественные и качественные показатели урожая, а само растение может даже погибнуть. Один из основных путей распространения болезней, особенно вирусных, — через посадочный материал.
В связи с этим, возникает вопрос о решении данной проблемы, который я раскрою в данной работе.
Клональное микроразмножение.
Одним из способов получения безвирусного посадочного материала является клональное микроразмножение.
Основное преимущество клонального микроразмножения - получение генетически однородного, безвирусного посадочного материала. Предположение о возможности отсутствия вирусов в меристематических тканях больных растений впервые было высказано в 1936 г. Чунгом, а позднее, в 1943 г., и Уайтом. В 1949 г. этот факт был подтвержден экспериментально. В 1952 г. Морелю и Мартену из Национального агрономического института (Франция) удалось получить безвирусные георгины из зараженных растений.
Структурной основой используемого на практике явления служит специфика строения точки роста растений: дистальная ее часть, представленная апикальной меристемой, у разных растений имеет средний диаметр 200 мкм и высоту от 20 до 150 мкм. В нижних слоях дифференцирующиеся клетки меристемы образуют прокамбий, дающий начало пучкам проводящей системы.
Известно, что успех клонального микроразмножения зависит от меристематического экспланта. При этом отмечается закономерность: чем больше листовых зачатков и тканей, тем легче идут процессы морфогенеза, заканчивающиеся образованием целого растения. Вместе с тем, при таком развитии конуса нарастания увеличивается риск быстрой транспортировки вируса по проводящей системе. Кроме того, даже небольшой меристематический эксплант может содержать вирусы, проникшие в клетки в результате медленного распространения через плазмодесмы.
В целом, эффективность применения апикальной меристемы в качестве метода оздоровления зараженных вирусами растений может оказаться довольно низкой. Снизить риск попадания вирусов в здоровые ткани можно путем применения предварительной термо- или химиотерапии исходных растений.
Этапы и методы клонального микроразмножения растений.
Процесс клонального микроразмножения можно разделить на четыре этапа: 1 - выбор растения-донора (донор - растение, часть которого вводится в культуру), изолирование эксплантов (эксплант - ткань, взятая из своего оригинального места и перенесенная в искусственную среду для роста и поддержания жизнедеятельности) и получение хорошо растущей стерильной культуры; 2 - собственно микроразмножение, когда достигается получение максимального количества мериклонов (микропобегов); 3 - укоренение размноженных побегов с последующей адаптацией их к почвенным условиям, а при необходимости депонирование растений-регенерантов при пониженной температуре (2-10 С); 4 - выращивание растений в условиях теплицы и подготовка их к реализации или посадке в поле (рис. 1).
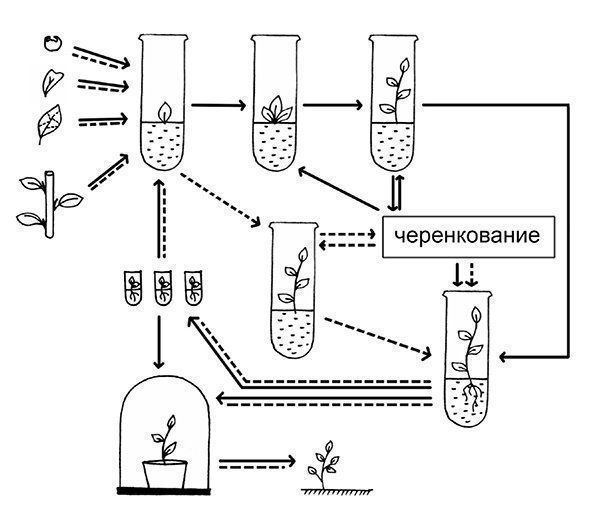
Рисунок 1. Схема клонального микроразмножения растений: I путь -активация развития существующих меристем; II путь - индукция возникновения адвентивных почек; 1 - выбор исходного экспланта; 2 - получение стерильной культуры; 3 - образование адвентивных почек на первичном экспланте; 4 - рост почек и формирование микропобегов; 5 - размножение микропобегов; 6 - укоренение микропобегов; 7 - депонирование растений-регенерантов; 8 - акклиматизация растений к грунту; 9 - высадка регенерантов в поле.
Существует много методов клонального микроразмножения. Различные авторы, проводя индивидуальные исследования по влиянию условий культивирования эксплантов на процессы морфогенеза, наблюдали разные ответные морфогенетические реакции на изменение условий выращивания, что, в свою очередь, способствовало созданию новых классификаций методов клонального микроразмножения. В литературе предложены следующие методы микроразмножения растений: активация развития уже существующих в растении меристем (апекс стебля, пазушные и спящие почки стебля); индукция возникновения адвентивных почек непосредственно тканями экспланта; индукция соматического эмбриогенеза; дифференциация адвентивных почек в первичной и пересадочной каллусной ткани. Первый метод, используемый при клональном микроразмножении растений, - это активация развития уже существующих в растении меристем, основывающийся на снятии апикального доминирования.
Это может быть достигнуто двумя путями:
1. Удаление верхушечной меристемы стебля (снятие апикального доминирования) и последующее микрочеренкование побега in vitro на безгормональной среде. Апикальное доминирование - подавление роста боковых почек растительного побега или наличие терминальной почки.
2. Добавление в питательную среду веществ цитокининового типа действия, индуцирующих развитие многочисленных пазушных побегов. Как правило, в качестве цитокининов используют 6-бензиламинопурин (БАП) или 6-фурфуриламинопурин (кинетин), а также 2-изопентениладенин (2-iр) и зеатин.
Полученные таким образом побеги отделяют от первичного материнского экспланта (инокулюм (трансплант) - часть суспензионной или каллусной культуры, переносимой в свежую питательную среду) и вновь самостоятельно культивируют на свежеприготовленной питательной среде, стимулирующей пролиферацию пазушных меристем и возникновение побегов более высоких порядков

Рисунок 2. Активация развития уже существующих в растении меристем, основывающаяся на снятии апикального доминирования: 1 -снятие апикального доминирования и последующее микрочеренкование побега in vitro на безгормоналыюй среде; 2 - индуцированное развитие многочисленных пазушных побегов под действием веществ цитокининового типа действия
В настоящее время этот метод широко используется в производстве безвирусного посадочного материала сельскохозяйственных культур, таких как технические (сахарная свекла, хмель, табак, топинамбур, стахис) и овощные (томаты, картофель, огурец, перец, тыква, спаржа и др.), а также для размножения культур промышленного цветоводства (гвоздика, хризантема, роза, гербера), тропических и субтропических растений (рододендрон, азалия, камелия, чай и др.), плодовых и ягодных культур (яблоня, слива, вишня, груша, виноград, малина, смородина, крыжовник и др.) и древесных растений (тополь, ива, ольха, береза, рябина, секвойя, туя, можжевельник и др.).
Для некоторых сельскохозяйственных культур, таких как картофель, технология клонального микроразмножения поставлена на промышленную основу (рис. 3).
Применение метода активации развития существующих в растении меристем позволяет получать из одной меристемы картофеля более 105 растений в год, причем технология предусматривает получение в пробирках микроклубней - ценного безвирусного семенного материала. Формирование растения капусты из пазушной почки показано на рис 4.

Рис. 3. Этапы размножения пробирочных растений картофеля черенкованием: а - микропобег - объект черенкования (линиями отмечены места разрезов при черенковании); б - микрочеренок на питательной среде; в - развитие растения картофеля из черенка (фото Н.В. Зобовой)

Рис. 4. Формирование растения капусты из пазушной почки на агаризованной питательной среде (фото Н.В. Зобовой): а - введение в культуру пазушной почки; б - развитие побега; в - формирование регенеранта
Второй метод - это индукция возникновения адвентивных почек непосредственно на тканях экспланта. (Адвентивный - добавочный побег. Развитие растений из необычных точек происхождения, например, почечные или корневые ткани, возникающие из каллуса, или зародыши, развивающиеся из других источников, а не из зигот. Этот термин также может быть использован для описания агентов, загрязняющих клеточные культуры). Он основан на способности изолированных частей растения при благоприятных условиях питательной среды восстанавливать недостающие органы и таким образом регенерировать целые растения.
Образования адвентивных почек можно добиться почти из любых органов и тканей растения (изолированного зародыша, листа, стебля, семядолей, чешуек и донца луковицы, сегментов корней и зачатков соцветий), если их удается получить свободными от инфекции. Этот процесс, как правило, происходит на питательных средах, содержащих один цитокинин или в сочетании с ауксином, находящихся в соотношении 10:1 или 100:1. В качестве ауксина в этом случае наиболее часто используют в -индолил-3-уксусную кислоту (ИУК) или а-нафтилуксусную кислоту (НУК).
Это наиболее распространенный метод микроразмножения высших растений, которым были размножены многие луковичные цветочные растения (нарциссы, лилии, гиацинты, гладиолусы, тюльпаны) из луковичных чешуи, сегментов базальной части донца луковиц, эксплантов листьев; представители рода Бразика (капуста цветная, кочанная, брюссельская, листовая, брокколи) - из сегментов гипокотиля, котиледона, листьев; лук, чеснок - из верхушечной меристемы, ткани донца луковиц; томаты - из апикальных или пазушных меристем; салат цикорный - из сегментов листовых пластинок; петуния - из сегментов корней; глоксиния, сенполия, стрептокарпус, эшинапсус - из сегментов листовых пластинок, а также некоторые представители древесных растений - из изолированных зрелых и незрелых зародышей.
Несомненный интерес вызывает вопрос, связанный с происхождением адвентивных почек, в частности, какие клеточные слои участвуют в дифференциации меристем. Единого мнения по этому вопросу пока нет. Так, Тран Тан Ван в своих работах с тканями табака установила, что именно эпидермис является наиболее активной тканью, способной образовывать почки, каллус или корни в зависимости от гормонального баланса питательной среды. Цитологические исследования, проведенные на сегментах базальной части донца луковиц тюльпанов и нарциссов, показали, что адвентивные побеги формируются из поверхностных слоев меристематических клеток, прилегающих к донцу, а для растений глоксинии, сенполии и стрептокарпуса процесс формирования адвентивных почек, как правило, происходит в субэпидермальных клеточных слоях листовых пластинок.
Единого мнения по этому вопросу также нет и среди исследователей, работающих с древесными растениями. Так, Арнольд и Эрихсон, Джонсон и Борнмап считают, что образование почек на изолированной хвое ели обыкновенной под действием БАП и 2ip происходит в эпидермальном слое культивируемого экспланта, по мнению Чин и Ченга, для псевдотсуги - в субэпидермальных слоях; а Вилалобос и другие утверждают, что при культивировании семядолей сосны замечательной на среде, содержащей один цитокинин, этот процесс происходит одновременно в эпидермальном и субэпидермальном слоях. Для сосны обыкновенной также было отмечено образование адвентивных почек в эпидермальном и субэпидермальном слоях семядолей зародыша. Этот процесс для сосны не зависит от применяемых цитокининов.
Третий метод, практикуемый при клональном микроразмножении, основывается на дифференциации из соматических клеток зародышеподобных структур, которые по своему внешнему виду напоминают зиготические зародыши. Этот метод получил название соматический эмбриогенез (рис. 5).
Основное отличие образования зародышей in vitro и in vivo (в естественных условиях) заключается в том, что соматические зародыши развиваются асексуально вне зародышевого мешка и по своему внешнему виду напоминают биполярные структуры, у которых одновременно наблюдается развитие апикальных меристем стебля и корня. Согласно Стеварду, соматические зародыши проходят три стадии развития: глобулярную, сердцевидную, торпедо-видную и в конечном счете имеют тенденцию к развитию в проросток.
Это явление впервые было отмечено в культуре клеток моркови еще в середине 50-х гг., а в настоящее время используется для размножения большинства растений из семейства «Orchidaceae» и «Rutaceae», а также для некоторых представителей злаковых (пшеница, ячмень), люцерны, редиса, винограда и некоторых видов древесных пород (осина, эвкалипт, дуб, ель обыкновенная).

Рис. 4.5. Образование растений путем соматического эмбриогенеза на сегментах листовых пластинок сенполии (фото Н.В. Зобовой)
Формирование эмбриоидов в культуре тканей происходит в два этапа. На первом этапе клетки экспланта дифференцируются за счет добавления в питательную среду ауксинов, как правило, 2,4-дихлорфеноксиуксусной кислоты (2,4-Д) и превращаются в эмбриональные. Для формирования эмбриоидов необходимо уменьшать концентрацию ауксина или полностью его исключать из состава питательной среды.
Соматический эмбриогенез возможно наблюдать непосредственно в тканях первичного экспланта, а также в каллусной культуре. Причем последний способ менее пригоден при клональном микроразмножении, так как посадочный материал, полученный таким методом, будет генетически нестабилен по отношению к растению-донору. Как правило, соматический эмбриогенез происходит при культивировании каллусных клеток в жидкой питательной среде (суспензии) и является наиболее трудоемкой операцией.
Однако этот метод размножения имеет свои преимущества, связанные с сокращением последнего (третьего) этапа клонального микроразмножения, не требующего подбора специальных условий укоренения и адаптации пробирочных растений, потому что соматические зародыши представляют собой полностью сформированные растеньица. При использовании соответствующей техники их капсулирования из этих эмбриоидов возможно получать искусственные семена.
Четвертый метод клонального микроразмножения - дифференциация адвентивных почек в первичной и пересадочной каллусной ткани. Каллус - неорганизованная, пролиферирующая масса дифференцированных растительных клеток. Дедифференциация - переход специализированных, неделящихся клеток к пролиферации. Практически он мало используется в целях получения посадочного материала in vitro.
Это связано с тем, что при периодическом пересаживании каллусной ткани на свежую питательную среду часто наблюдаются явления, нежелательные при микроразмножении: изменение плоидности культивируемых клеток, структурные перестройки хромосом и накопление генных мутаций, потеря морфогенетического потенциала культивируемыми клетками.
Наряду с генетическими изменениями наблюдаются изменения растений и по морфологии: низкорослость, неправильное жилкование листьев и их расположение по стеблю, образование укороченных, утолщенных междоузлий, уродливость, пониженная устойчивость к болезням и вредителям. Причем длительное культивирование каллусных клеток усугубляет эти изменения, поэтому период неорганизованного роста при микроразмножении должен быть сведен к минимуму.
Однако несмотря на некоторые недостатки, данный метод имеет свои положительные стороны и преимущества.
Во-первых, он является эффективным и экономически выгодным, так как в процессе размножения из каждой индивидуальной каллусной клетки при определенных благоприятных условиях культивирования может сформироваться адвентивная почка, дающая начало новому растению. Во-вторых, в ряде случаев он является единственно возможным способом размножения растений в культуре тканей. В-третьих, представляет большой интерес для селекционеров, так как растения, полученные данным методом, отличаются генетически и морфологически друг от друга. Это дает возможность селекционерам проводить отбор растений по хозяйственно важным признакам и оценивать их поведение в полевых условиях.
Этот метод целесообразно применять лишь к тем растениям, для которых показана генетическая стабильность каллусной ткани, а вариабельность между растениями-регенерантами не превышает уровня естественной изменчивости.
К таким растениям можно отнести амариллис, эписции, драцены, томаты, спаржу, некоторые древесные породы и другие культуры. Через каллусную культуру были размножены: сахарная свекла, некоторые представители рода Бразика, кукуруза, рис, пшеница и другие злаковые, подсолнечник, лен. Разработаны условия, способствующие регенерации растений из каллуса огурца, картофеля, томатов.
В целом методы клонального микроразмножения, несомненно, имеют ряд преимуществ перед существующими традиционными способами размножения:
- получение генетически однородного посадочного материала;
- освобождение растений от вирусов за счет использования меристемной культуры;
- высокий коэффициент размножения (10 5-10 6 - для травянистых, цветочных растений, 10 4-10 5 - для кустарниковых и древесных, 104 - для хвойных);
- сокращение продолжительности селекционного процесса;
- ускорение перехода растений от ювенильной к репродуктивной фазе развития;
- размножение растений, трудно размножаемых традиционными способами;
- возможность проведения работ в течение круглого года и экономия площадей, необходимых для выращивания посадочного материала;
- возможность автоматизации процесса выращивания.
Метод термотерапии
Метод термотерапии применяется как в условиях in vivo, так и in vitro и предусматривает использование горячего сухого воздуха. Для объяснения механизма освобождения растений от вирусов в процессе термотерапии существуют различные гипотезы. Согласно одной их них при высоких температурах разрушаются белковая оболочка и нуклеиновая кислота вируса. Вторая гипотеза предполагает действие высоких температур на вирусы через метаболизм растений. При такой температуре начинает преобладать деградация вирусных частиц, а синтез их, наоборот, уменьшается. Растения, подвергающиеся термотерапии, помещают в термокамеры, где температура в течение первой недели повышается с 25 до 37оС путем ежедневного увеличения температуры на 2 градуса. Все остальные режимы обязательно поддерживаются в оптимальном состоянии: освещенность, высокая относительная влажность воздуха, определенный фотопериод. Продолжительность термостатирования зависит от состава вирусов и их термостойкости. Если для гвоздики достаточно 10 - 12 недельного воздействия теплом, то для хризантемы этот период превышает 12 недель.
Помимо положительного действия высоких температур на освобождение от вирусов, выявлено аналогичное влияние их на точку роста и процессы морфогенеза некоторых цветочных культур (гвоздики, фрезии) в условиях in vitro. Высокие температуры увеличивают коэффициент размножения на 50 - 60%, повышаю адаптацию пробирочных растений к почвенным условиям и позволяют получить больше безвирусных маточных растений.
Применение термотерапии позволяет увеличивать коэффициент размножения на 50-60 %, повысить адаптацию пробирочных растений-регенерантов к почвенным условиям, а также получить более высокий процент безвирусных маточных растений.
Использование термотерапии в сочетании с меристемной культурой дает возможность оздоровить более 70 % растений-регенерантов хмеля от вирусного хлороза, 90 % земляники, 25 % растений черной и красной смородины, 50 % малины, более 80 % картофеля. Растения на наличие вирусов, как правило, проверяют с помощью иммуноферментного анализа, электронной микроскопии и травянистых растений-индикаторов.
Хемотерапия.
Другой способ, применяемый для освобождения растений от вирусов, - хемотерапия. Он заключается в добавлении в питательную среду, на которой культивируют апикальные меристемы, аналога «гуанозина» Д-рибофуранозил-1,2,4-триазол-карбоксимида (коммерческое название - вирозол) концентрацией 20-50 мг/л. Это противовирусный препарат широкого спектра действия.
При использовании «вирозола» в культуральной среде процент безвирусных меристемных растений увеличивался до 80 % по сравнению с 40 % на контроле. Положительные результаты получены для сливы, черешни, малины, некоторых цветочных и других растений.
Лечение заболевших растений с помощью химических веществ, вводимых внутрь растения, получило название хемотерапии, или внутренней химической терапии растений.
В основном этот способ применения химических веществ направлен на лечение растений от болезней, возбудители которых находятся внутри тканей, скрытно. Он заключается в уничтожении химическими препаратами внедрившегося возбудителя болезни или, когда он уже находится внутри тканей растения, но без нанесения этим мероприятием ущерба растению-хозяину. Иногда вводимые во внутрь препараты полностью не уничтожают возбудителя и окончательно не излечивают растение, но этот прием значительно снижает наносимый болезнями ущерб.
Применяемые для хемотерапии химические вещества и препараты, обладающие свойством передвигаться естественными токами по всему растению, называются системными, или внутрирастительными, фунгицидами. Они должны хорошо растворяться, быстро обеспечивать обеззараживание поверхности, поглощаться растением в таком количестве, чтобы обеспечить внутреннюю защиту растения от болезни, не оказывая при этом на него ядовитого действия. Системные фунгициды должны обладать высокой стойкостью, не разрушаться внутри растения и обладать свойством передвигаться в различные его органы, в том числе и во вновь образующиеся листья, побеги и корни, защищая их от заболевания в течение продолжительного времени.
Защита растений веществами системного действия может быть осуществлена различными путями. Сюда относятся: 1) обработка семян и посадочного материала перед посевом — мокрое протравливание, сухое опудривание и замачивание семян в растворах или суспензиях хемотерапевтических веществ; вымачивание посадочного материала в растворах этих веществ; 2) обработка растений — нанесение веществ внутрирастительного действия на листья и стебли путем опрыскивания или опыливания в зависимости от физического состояния вещества (внекорневая подкормка); 3) введение веществ внутрь растения — инъекция вещества под давлением в ствол или стебель, накладка влажной повязки на стебель или прикорневую шейку; 4) внесение в почву веществ, которые, будучи поглощенными корневой системой растения, окажут защитное действие от поражения патогенными организмами.
Идея защиты растений с помощью веществ внутрирастительного действия впервые была выдвинута и частично осуществлена русскими исследователями И. Я. Шевыревым и С. А. Мокржецким. В течение 1892—1903 гг. русский энтомолог Шевырев, а затем в 1902—1904 гг. Мокржецкий проводили опыты введения в растения веществ для борьбы с грибными болезнями виноградной лозы, яблони и груши. Предложенный ими прием введения веществ в ствол дерева они назвали внекорневым питанием, а для его осуществления сконструировали специальное приспособление (прибор Мокржецкого). Мокржецкий испытывал способы введения веществ, их состав, а также продолжительность действия внекорневого питания, утверждая при этом, что действие веществ на растение не беспрерывно, а ограничивается двумя-тремя годами, что также зависит и от количества введенных солей, и от состояния самого дерева.
В работах этих исследователей приводятся примеры излечивания яблонь введением в ствол дерева раствора железного купороса, а также виноградной лозы при лечении ее раствором медного купороса.
Независимо от И. Я. Шевырева и С. А. Мокржецкого опыты лечения больных деревьев от хлороза проводились в России еще в 1895 и 1896 гг. крымским садоводом Н. П. Николаевым-Цыганковым, работа которого «Лечение деревьев от желтухи» опубликована в 1898 г.
Несмотря на это, только недавно в проблеме защиты растений с помощью веществ внутрирастительного действия наметился кое-какой прогресс и определилось более ясное понимание процесса. Этому способствовали успехи химии и изменения взгляда на природу этого процесса. Длительное время в науке господствовало мнение, что внутри растений не имеется замкнутой циркуляции соков и поэтому невозможно у них создать иммунитет типа приобретенного иммунитета у животных. Но это не совсем так, и в настоящее время эта концепция быстро уступает место новым воззрениям, согласно которым фунгициды системного действия, введенные внутрь растения, распространяются по всем его тканям и на длительный срок предохраняют его от определенных болезней. Для выяснения природы действия химических веществ системного действия и повышения их эффективности в борьбе с болезнями растений все больше предпринимается попыток установить связь этих веществ с процессами обмена у растений-хозяев и у возбудителей их болезней.
Хемотерапевтический способ применения химических веществ в настоящее время привлекает к себе усиленное внимание многочисленных исследователей, и в области защиты растений от болезней этот способ успел дать результаты, имеющие практическое значение.
Наибольшее значение имеют исследования И. М. Полякова по созданию фунгицидов внутрирастительного действия для уничтожения внутренней инфекции пыльной головни пшеницы и замене термической дезинфекции химическим способом борьбы с этим заболеванием.
Им предложен новый химический препарат — родан, который испытан в различных зонах Советского Союза на больших площадях и во многих случаях показал высокую эффективность против пыльной головни яровой пшеницы. Новый химический способ более прост по организации работ, может быть применен для заблаговременного обеззараживания семян, в 2 раза дешевле, чем термический способ.
Препарат «родан» является одновременно химическим иммунизатором основных зерновых культур в борьбе с болезнями, в частности против ржавчины. При использовании этого препарата для обработки семян пшеницы против бурой ржавчины было установлено снижение, поражаемое растений как в год обработки семян, так и на другой год, в следующем поколении, когда семена перед посевом ничем не обрабатывались. Химическая обработка семян «роданом» вызывает изменение обмена веществ растения и приводит к повышению болезнеустойчивости растений против ржавчинных грибов.
Хемотерапевтический метод может быть применен для лечения деревьев абрикоса, пораженных бактериальным ожогом, или раком косточковых. Эта болезнь является бичом южного садоводства, так как возбудитель болезни «Preudomonas cerasi Griff», глубоко проникает в ткани растения, обладает способностью длительного периода заражения, а эффективных средств химической защиты от заболевания нет. На Мелитопольской опытной станции садоводства проведен опыт применения хемотерапевтического метода в борьбе с этим заболеванием (А. К. Василькова).
Лечению подвергались пораженные хронической формой болезни, ослабленные деревья абрикосов и черешен, а в качестве веществ внутрирастительного действия испытывались формалин и ряд органических кислот и их солей. Эти вещества вводились внутрь растения через отверстия из сосуда с помощью марлевого фитиля.
Эффективным было введение в черешни 1%-ного раствора сернокислого цинка, немного хуже действовал 0,3%-ный цинксалициланилид на аммиаке.
На абрикосах применение цинка оказалось не таким эффективным, зато хорошее действие оказал формалин в разбавлении 1:300.
Для осуществления в широких масштабах хемотерапии растений к настоящему времени создан ряд химических веществ, обладающих в разной степени системным действием. К числу таких веществ относятся производные гидрооксихинолина, дитиокарбаматы, роданиды; соли металлов, в том числе железа, ртути, цинка, свинца и калия; сульфамиды; салициловая и пикриновая кислоты, а также многие антибиотики и другие вещества.
Кроме перечисленных и других химических веществ, и соединений, свойством внутрирастительного действия обладают и многие антибиотические вещества. Использование антибиотиков в качестве хемотерапевтического средства наиболее перспективно в борьбе с вирусными заболеваниями, а также при поражении сосудистой системы, сопровождающемся увяданием и загниванием растения. Возможность применения антибиотиков в лечебных целях у нас в стране доказана лабораторными и полевыми опытами, проведенными с разными культурами в различных научных учреждениях.
В Академии наук Армянской ССР (Р. О. Мирзабекян) был применен антибиотик «гризин» для лечения абрикосовых и персиковых деревьев, пораженных бактериальным увяданием, вызываемым «Xanthomonas armetiiaca». Опыт проводился на сеянцах и плодоносящих деревьях. На молодых растениях, предварительно зараженных бактериозом, водный раствор антибиотика вводился через листовую поверхность путем смачивания ее. При плодоносящих растениях антибиотик вводился в ствол, а также им опрыскивалась крона дерева.
Во всех случаях применения «гризина» получены положительные результаты его действия на лечение и оздоровление растений. На молодых растениях, обработанных препаратом, болезнь не появилась совсем, а необработанные сеянцы все погибли. После введения «гризина» в пораженное увяданием растение процесс его увядания и засыхания приостанавливался, на живых частях растения появлялись новые побеги и растение продолжало расти нормально. Таким образом, проведенные опыты свидетельствуют о том, что действие антибиотиков проявляется не только в предохранении молодых растений от заболеваний, но и в лечении заболевших растений.
Приведенный краткий обзор возможных путей использования химических веществ и антибиотиков внутрирастительного действия свидетельствует о преимуществе и перспективности хемотерапевтического способа химической защиты растений от болезней. Его преимущество состоит в том, что системные фунгициды во много раз упрощают и облегчают борьбу с болезнями растений. При обычном химическом способе на многих культурах (виноград, плодовые, овощные) приходится производить опрыскивание и опыливание по многу раз в течение сезона. Для того чтобы каждое такое опрыскивание или опыливание произвести вовремя и в сжатые сроки, приходится сразу пускать большое количество машин, что усложняет и удорожает работу. При этом эффективность препаратов и способов обработки невысока, так как химические препараты оседают преимущественно на верхнюю поверхность листьев, а нижняя сторона листьев и некоторые ветви остаются незащищенными от возбудителей болезней.
В то же время при обработке растений системными фунгицидами совершенно достаточно, чтобы препарат попал хотя бы на один лист, часть стебля или часть корневой системы, откуда он распространяется по всей сосудистой системе растения, попадая во все органы, и таким образом осуществляет защитное действие всего растения в течение длительного времени.
В целом способ хемотерапии с применением препаратов внутрирастительного действия более перспективный, чем метод применения защитных фунгицидов, но он еще мало разработан. Возможно, что в недалеком будущем защита растений с помощью хемотерапевтических веществ будет осуществляться не путем нанесения на поверхность растений больших количеств фунгицидов, а путем обработки растений минимальным количеством системных препаратов, сосредоточив всю обработку в одной единственной операции.
Адаптация клонов
Процесс адаптации пробирочных растений к почвенным условиям является наиболее дорогостоящей и трудоемкой операцией.
Нередко после пересадки растений в почву наблюдается остановка в росте, опадение листьев и гибель растений. Эти явления связаны, в первую очередь, с тем, что у пробирочных растений нарушена деятельность устьичного аппарата, вследствие чего происходит потеря большого количества воды.
Во-вторых, у некоторых растений в условиях in vitro не происходит образования корневых волосков, что приводит, в свою очередь, к нарушению поглощения воды и минеральных солей из почвы. Поэтому целесообразно на третьем или четвертом этапах клонального микроразмножения применять искусственную микоризацию растений (для микотрофных), учитывая их положительную роль в снабжении растений минеральными и органическими питательными веществами, водой, биологически активными веществами, а также в защите растений от патогенов.
Индийскими учеными предложен простой метод предотвращения быстрого обезвоживания листьев растений, выращенных in vitro, во время их пересадки в полевые условия. Метод заключается в том, что листья в течение всего акклиматизационного периода следует опрыскивать 50%-ным водным раствором глицерина или смесью парафина, или жира в диэтиловом эфире (1:1). Применение этого метода помогает избежать длинных и затруднительных процессов закаливания пробирочных растений и обеспечивает 100%-ную их приживаемость.
 2020-07-12
2020-07-12 882
882







