Величина потенциала электрода зависит от природы материала электродов, от концентрации их ионов в растворе и от температуры. Поэтому для характеристики природы этого вещества и сравнения его с другими материалами измерение их потенциалов необходимо проводить в стандартных (сопоставимых) условиях – при одинаковых концентрациях потенциалобразующих ионов. В соответствии с этим стандартный электродный потенциал – это потенциал электрода при стандартных (нормальных) условиях, т. е. при концентрации ионов 1 г-экв/л; его обозначают символом Е 0.
Зависимость равновесного потенциала (Е) электрода от концентрации потенциалопределяющих ионов выражается уравнением Нернста для отдельного электрода:
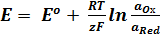 .
.
где Е – электродный потенциал, В
Ео – стандартный электродный потенциал – потенциал электрода при активности ионов равной 1.
R – универсальная газовая постоянная, равная 8,314 Дж/моль К
T – температура, К
z – число электронов, принимающих участие в электродной реакции;
F – постоянная Фарадея, равная 96500 Кл/моль
a Ox и a Red – активности окисленной и восстановленной форм.
Для температуры 298 К (25оС) уравнение Нернста при переходе от натурального логарифма к десятичному принимает вид:
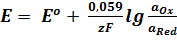 .
.
Если восстановленной формой является твердое состояние, то активность твердого вещества (a Red) принимается равной единице, уравнение Нернста упрощается:
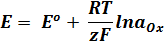
Зная стандартный электродный потенциал Ме, можно рассчитать по уравнению Нернста его электродный потенциал при любой концентрации ионов в растворе.
Пример:
При 298 К и активности ионов а = 0,005 потенциал электрода Cu2+ | Cu равен +0,2712 В. Вычислите стандартный потенциал медного электрода.
Решение: стандартный потенциал медного электрода рассчитывают, используя уравнение:
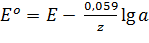
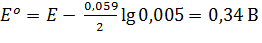
 2020-06-29
2020-06-29 412
412








