Урок 55 Лекция
Тема: «Скорость химических реакций»
Химические реакции протекают с разными скоростями. Очень быстро, практически мгновенно проходят реакции в водных растворах. Смешаем растворы хлорида бария и сульфата натрия — сульфат бария в виде осадка образуется немедленно. Быстро, но не мгновенно горит сера, магний растворяется в соляной кислоте, этилен обесцвечивает бромную воду. Медленно образуется ржавчина на железных предметах, налет на медных и бронзовых изделиях, гниет листва.
Скорость химической реакции - это величина, показывающая как изменяются концентрации исходных веществ или продуктов реакции за единицу времени.
Если химические реакции происходят в однородной среде, например, в растворе или в газовой фазе, то взаимодействие реагирующих веществ происходит во всем объеме. Такие реакции, как вы знаете, называют гомогенными.
Скорость гомогенной реакции (v гомог) определяется как изменение количества вещества в единицу времени в единице объема:

где Δn — изменение числа молей одного из веществ (чаще всего исходного, но может быть и продукта реакции); Dt — интервал времени (с, мин); V — объем газа или раствора (л).
Поскольку отношение количества вещества к объему представляет собой молярную концентрацию С, то

Таким образом, скорость гомогенной реакции определяется как изменение концентрации одного из веществ в единицу времени:
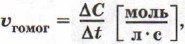 если объем системы не меняется.
если объем системы не меняется.
Если реакция идет между веществами, находящимися в разных агрегатных состояниях (например, между твердым веществом и газом или жидкостью), или между веществами, неспособными образовывать гомогенную среду (например, между несмешивающимися жидкостями), то она проходит только на поверхности соприкосновения веществ. Такие реакции, как вы также знаете, называют гетерогенными.
Скорость гетерогенной реакции определяется как изменение количества вещества в единицу времени на единице поверхности:

где S — площадь поверхности соприкосновения веществ (м 2, см 2).
Таким образом, для гетерогенных реакций одним из факторов, определяющих скорость химической реакции, является величина площади поверхности соприкосновения реагирующих веществ.
Следовательно, чтобы определить, с какой скоростью протекает химическая реакция, нужно знать:
а) какое количество вещества (моль) образуется (для продукта реакции) или расходуется (для исходного вещества);
б) за какое время происходит этот процесс;
в) в каком объёме протекает реакция.
Знание скоростей химических реакций имеет очень большое практическое и научное значение. Например, в химической промышленности от скорости химической реакции зависят размеры, производительность аппаратов, количество вырабатываемого продукта и в конечном счёте зарплата работников и себестоимость продукции.
Раздел химии, изучающий скорость химических реакций, называют химической кинетикой. Зная её законы, человек получает возможность управлять скоростью химических процессов.
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
При повышении концентрации хотя бы одного из реагирующих веществ скорость химической реакции возрастает в соответствии с кинетическим уравнением.
Рассмотрим общее уравнение реакции:
aA +bB = cC + dD, где A,B,C,D – газы, жидкости
Для данной реакции кинетическое уравнение принимает вид:

k – константа скорости реакции
Причиной повышения скорости является увеличение числа столкновений реагирующих частиц за счёт увеличения частиц в единице объёма.
Ответьте на вопросы
1. Что подразумевается под скоростью химической реакции?
2. От чего зависит скорость реакции, протекающей в гетерогенной среде?
 2020-06-29
2020-06-29 307
307






