Класс
ХИМИЯ
17.04.2020
Тема: Растворяемые вещества и растворители. Полярные и неполярные растворители. Вода. Понятие о водородной связи.
В классной работе записать число, классная работа
Составить краткий конспект
Растворы — это многокомпонентные системы. Один из компонентов называется растворителем. Обычно это вещество, что находится в том же агрегатном состоянии, что и раствор. Если все компоненты раствора находятся в одном агрегатном состоянии, то растворителем считается тот компонент, которого в растворе больше.

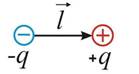
Полярные растворители – это химические соединения, молекула которых является диполем. Все полярные представители в своей молекуле имеют донорные атомы, но при этом подразделяются на содержащие подвижные протоны или протонные (воду, карбоновые кислоты, амины), а также не содержащие такие протоны, другое название апротонные (кетоны, простые эфиры, а также третичные амины).
Поля́рные вещества́ в химии — соединения, молекулы которых обладают электрическим дипольным моментом. Для полярных веществ, в сравнении с неполярными, характерны высокая диэлектрическая проницаемость (более 10 в жидкой фазе), повышенные температура кипения и температура плавления.
Дипольный момент обычно возникает вследствие разной электроотрицательности составляющих молекулу атомов, из-за чего связив молекуле приобретают полярность.
Полярность химических связей — характеристика химической связи (как правило, ковалентной), показывающая изменение распределения электронной плотности в пространстве вокруг ядер в сравнении с распределением электронной плотности в образующих данную связь нейтральных атомах.
К достоинствам полярных растворителей можно отнести:
- способность к образованию водородных связей;
- содержание кислого протона;
- способность к стабилизации ионов: катионов – за счет неподеленной пары электронов; анионов – за счет полученных водородных связей.
- высокая диэлектрическая проницаемость;
- способность растворять различные полярные органические вещества;
- широкие температурные пределы жидкого состояния.
Наиболее известными и часто используемыми представителями этого класса являются вода, метиловый спирт, глицерин.
Неполярные вещества – это соединения, молекула которых диполем не является. Они не растворяют соли и основания, часто в реакциях выступающих нуклеотидными реагентами. Поэтому в таких случаях данные растворители применяются редко. Также они имеют низкую температуру кипения, что не позволяет их использовать в реакциях с термическим возбуждением молекул.
Неполярные смеси великолепно растворяют неполярные молекулы газов. Это свойство достаточно широко используется для получения сжатых газов, структура которых крайне неустойчива и опасна, но в растворенном состоянии они прекрасно транспортируются и хранятся в стальных баллонах. Наиболее известные растворители данного класса – это ацетон, уайт-спирит, бензол.
В том случае, если одним из компонентов является вода, то именно она и будет растворителем.
Вода — универсальный растворитель всех веществ на Земле.
Молекула воды представляет собой диполь, содержащий положительный и отрицательный заряды на полюсах.
Свойства воды как растворителя:
- высокая диэлектрическая проницаемость - вода активно растворяет вещества с полярными молекулами
- образование водородных связей между частицами в-ва и молекулами воды
- низкая вязкость воды
свойства воды как растворителя определяются строением молекул воды

По реакции с водой все вещества делятся на три группы:
• растворимые;
• малорастворимые;
• практически нерастворимые.
Обращаемся к таблице растворимости, вспоминаем, как использовать эту таблицу для определения растворимости веществ в воде.
— Как можно объяснить такую особенность молекул воды?
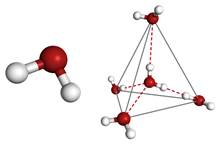
Обратимся к строению молекулы воды и рассмотрим схему.

Тип связи — ковалентная полярная, угол связи — 104,5°.
Тип кристаллической решетки — молекулярная.
— Молекулярная решетка? Почему же при нормальных условиях вода — жидкость?
Молекула воды полярная — диполь. Между молекулами воды возникает взаимное притяжение при температуре менее 100 °С. Такая связь называется водородным.
Рассматриваем схему водородной связи между молекулами воды.
Благодаря полярности и электронному строению молекул воды между ними образуется особый тип химической связи — водородная связь. В отличие от уже известных вам типов химической связи, водородная связь является межмолекулярной, то есть образуется между молекулами.
При образовании молекулы воды между атомами Оксигена и Гидрогена возникают две общие электронные пары, определяющие ковалентную связь в молекуле воды. При этом у атома Оксигена еще остаются две неподеленные электронные пары:
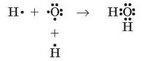
Эти электронные пары образуют повышенную электронную плотность вокруг атома Оксигена и позволяют ему взаимодействовать с другими частицами (ионами или молекулами), у которых «дефицит» электронной плотности. В молекуле воды связь между атомом Гидрогена и Оксигена очень полярная, то есть общие электронные пары значительно смещены в сторону атома Оксигена. Благодаря этому на атомах Гидрогена появляется «дефицит» электронов и возникает некоторый частичный положительный заряд.
Значит, между атомом Оксигена одной молекулы воды и атомом Гидрогена другой молекулы возникает дополнительное взаимодействие:


Такое взаимодействие называют водородной связью и обозначают рядом точек. Эта связь не так сильна, как ковалентная, но ее достаточно, чтобы удерживать молекулы воды вместе.
Водородная связь — это взаимодействие атома Гидрогена, соединенного с электроотрицательным атомом (Оксигена, Нитрогена или Флуора), одной молекулы со значительно более электроотрицательным атомом другой молекулы.
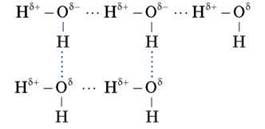

Такая связь возможна между молекулами воды и молекулами полярных растворенных веществ. Такая особенность молекул воды — одна из причин ее растворимой силы.
 2020-06-29
2020-06-29 230
230







