Элементы 13-й группы: бор 5В, алюминий 13Аl, галлий 31Ga, индий 49In и таллий 81Тl — имеют мало стабильных изотопов, что характерно для атомов с нечетными порядковыми номерами. Электронная конфигурация основного состояния ns2np1 характеризуется наличием единственного неспаренного электрона. В возбужденном состоянии они содержат три неспаренных электрона, которые, находясь в sp2-гибридизации, участвуют в образовании трех ковалентных связей. При этом у атомов элементов 13-й группы остается одна незанятая орбиталь, и число валентных электронов оказывается меньше числа доступных по энергии орбиталей. Поэтому многие ковалентные соединения элементов 13-й группы являются кислотами Льюиса — акцепторами электронной пары, приобретая которую, они не только повышают координационное число до четырех, но и изменяют геометрию своего окружения — она из плоской становится тетраэдрической (состояние sp3-гибридизации).
Бор сильно отличается по свойствам от других элементов 13-й группы. Он — единственный неметалл, химически инертен и образует ковалентные связи В—F, В—N, В—С и т.д., кратность которых часто повышена за счет рπ-рπ - связывания. Химия бора более близка химии кремния, в этом проявляется диагональное сходство.
У атомов алюминия и его тяжелых аналогов появляются вакантные d-орбитали, возрастает радиус атома, поэтому координационное число увеличивается до шести (и более).
Галлий, индий и таллий расположены в Периодической системе сразу за металлами d-блока, поэтому их часто называют постпереходными элементами. Заполнение d-оболочки сопровождается последовательным сжатием атомов, в 3d-ряду оно оказывается настолько сильным, что нивелирует возрастание радиуса при появлении четвертого энергетического уровня. В результате d-сжатия ионные радиусы алюминия и галлия близки, а атомный радиус галлия даже меньше, чем алюминия.
Энергия ионизации атомов элементов 3-й (13-й) группы главной подгруппы более высокая, чем элементов 3-й(13-й) группы побочной подгруппы, что связано с усилением взаимодействия ns- и nр-электронов с ядром за счет заполнения d- и f-оболочек электронами, слабо экранирующими заряд ядра.
Для соединений элементов 13-й группы наиболее характерна степень окисления +3. В ряду В—AI—Ga—In—Тl устойчивость таких соединений уменьшается, а устойчивость соединений со степенью окисления +1, напротив, увеличивается. Энергия связи М—Г в галогенидах при переходе от легких к более тяжелым элементам уменьшается, амфотерные свойства оксидов и гидроксидов смещаются в сторону большей основности.
Химия индия и особенно галлия вообще очень близка химии алюминия. Соединения этих металлов в низших степенях окисления (Ga20, Ga2S, InCl, In[lnCl4] и др.) в водных растворах диспропорционируют: 3lnСl = InС13 + 2 In. Для таллия состояние +1, напротив, является наиболее устойчивым вследствие инертности электронной пары 6s2.
Бор сравнительно мало распространен в земной коре (9 • 10-4 мас. %), где он встречается в виде кислородных соединений: боратов и боросиликатов. От названия одного из них — буры Na2B407.Н2О (лат. borax) — и происходит название элемента.
Алюминий по содержанию в земной коре (8,3 мас.%) занимает третье место, уступая только кислороду (45,5 мас.%) и кремнию (25,7 мас.%). Алюминий — наиболее распространенный металл, его важнейшими рудами и минералами являются бокситы А12О3.2Н2О корунд А12О3 и нефелин Na3K[AlSiО4]4, также он входит в состав полевых шпатов, слюд, глин и др.
Галлий (4,6 • 10-4 мас.%), индий (2 • 10-6 мас.%) и таллий (8 • 10-7 мас.%) относятся к редким элементам. Вследствие близости ионных радиусов галлий сопутствует алюминию в бокситах, а таллий — калию в алюмосиликатах.
Бор — тугоплавкий диамагнитный порошок черного (кристаллический) или бурого (аморфный) цвета, плохой проводник тепла и электричества. Алюминий, галлий, индий и таллий — серебристые металлы с характерным блеском и высокой электро- и теплопроводностью. При хранении на воздухе таллий быстро темнеет, так как покрывается пленкой оксида.
Кристаллический бор химически инертен. С кислородом он реагирует лишь около 750 °С с образованием оксида В203. Кипящие концентрированные растворы HF, НС1 и NaOH на него не действуют. Аморфный бор химически более активен и медленно окисляется горячими концентрированными HN03, H2S04, хромовой смесью, концентрированными растворами Н202 и (NH4)2S2О8:
В + 3HN03 = Н3ВО3 + 3N02
Реагирует с расплавленными Na202 и KNО 3 /Na 2 CО3, а в присутствии окислителя — и с щелочами:
4В + 4NaOH + 302 = 4NaB02 + 2Н20
Смеси аморфного бора с КМn04 и РЬ02 при растирании загораются, а смеси с НIO3 взрываются. При высоких температурах бор реагирует с большинством простых веществ, за исключением Н2, Ge, Те, инертных газов и ртути.
Алюминий, галлий и индий взаимодействуют с неметаллами (02, N2, S, галогенами Х2 и др.), образуя соответствующие оксиды М203, нитриды MN, сульфиды M2S3, галогениды МХ3. В избытке металла могут быть получены низшие сульфиды (GaS, InS) и галогениды (InBr, In[InBr4]). Таллий в этих условиях образует соединения со степенью окисления +1.
Реакция окисления алюминия кислородом сопровождается выделением большого количества теплоты и используется для восстановления многих металлов из их оксидов, например:
2Аl + Fe203 = Аl203 + 2Fe
Со многими металлами алюминий и его аналоги образуют химические соединения — интерметаллиды, например CuA12, Al2CuMg и др.
Металлы Аl, Ga, In, Тl располагаются левее водорода в ряду напряжений, и их окисление водой и кислотами-неокислителями термодинамически возможно:
2А1 + 6Н+ + 12Н20 = 2[Аl(Н20)6]3+ + ЗН2
Индий и таллий также растворяются в кислотах, но таллий (из-за понижения устойчивости соединений Тl(III) при взаимодействии с кислотами-неокис- лителями образует соли Т1(1). Реакция таллия с галогеноводородными кислотами НХ (X = Cl, Br, I) тормозится вследствие низкой растворимости галогенидов. Производные Tl(III) образуются при действии на Tl «царской водки» (три объема НСl(конц.) + один объем HNO3(конц.)) и других сильных окислителей.
Основные свойства соединений возрастают в ряду Аl — Ga— In—Тl, а кислотные свойства убывают. Алюминий и галлий подобно некоторым типичным неметаллам реагируют со щелочами, которые растворяют защитный оксидный слой:
2А1 + 2NaOH + 10Н20 = 2Na[Al(H20)2(0H)4] + ЗН2
Бор. Причина преобладания у бора неметаллических свойств. Получение бора, его физические и химические свойства. Соединения бора с металлами и неметаллами. Карбид бора; нитрид бора гексагональный и кубический (боразон). Галогениды бора. Неорганические полимеры на основе соединений бора. Тетрафтороборная кислота, ее соли. Боразол – аналог бензола.
Бор — элемент главной подгруппы третьей группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 5. Бор — тугоплавкий диамагнитный порошок черного (кристаллический) или бурого (аморфный) цвета, плохой проводник тепла и электричества. Известно более 10 аллотропных модификаций бора. Впервые получен в 1808 году французскими физиками Ж. Гей-Люссаком и Л. Тенаром нагреванием борного ангидрида B2O3 с металлическим калием. Через несколько месяцев бор получил Х. Дэви электролизом расплавленного B2O3. Чрезвычайно твёрдое вещество (уступает только алмазу, нитриду углерода, нитриду бора (боразону), карбиду бора, сплаву бор-углерод-кремний, карбиду скандия-титана). В природе бор находится в виде двух изотопов 10В (20 %) и 11В (80 %).
10В имеет очень высокое сечение поглощения тепловых нейтронов, поэтому 10В в составе борной кислоты применяется в атомных реакторах для регулирования реактивности.
Химические свойства.
По многим физическим и химическим свойствам неметалл бор напоминает кремний.
Химически бор довольно инертен и при комнатной температуре взаимодействует только со фтором:
При нагревании бор реагирует с другими галогенами с образованием тригалогенидов, с азотом образует нитрид бора BN, с фосфором — фосфид BP, с углеродом — карбиды различного состава (B4C, B12C3, B13C2). При нагревании в атмосфере кислорода или на воздухе бор сгорает с большим выделением теплоты, образуется оксид B2O3:

С водородом бор напрямую не взаимодействует, хотя известно довольно большое число бороводородов (боранов) различного состава, получаемых при обработке боридов щелочных или щелочноземельных металлов кислотой:
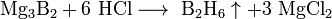
При сильном нагревании бор проявляет восстановительные свойства. Он способен, например, восстановить кремний или фосфор из их оксидов:


Данное свойство бора можно объяснить очень высокой прочностью химических связей в оксиде бора B2O3.
При отсутствии окислителей бор устойчив к действию растворов щелочей. В горячей азотной, серной кислотах и в царской водке бор растворяется с образованием борной кислоты.
Оксид бора — типичный кислотный оксид. Он реагирует с водой с образованием борной кислоты:

При взаимодействии борной кислоты со щелочами возникают соли не самой борной кислоты — бораты (содержащие анион BO33−), а тетрабораты, например:

Получение.
Аморфный бор, сильно загрязненный боридами металлов, получают металлотермическим восстановлением оксида или обезвоженной буры:
В203 + 3Mg = 2В + 3MgO
Более чистый продукт образуется при восстановлении летучих соединений бора водородом на нагретой до 1150 °С танталовой проволоке:
2BBr3 + ЗН2 = 2В + 6НВr или при их термическом разложении:
2BI3+2H2 = 2В + 3I2
Соединения бора.
Сульфид бора (B2S3) образуется в виде бесцветной стекловидной массы при накаливании бора в парах серы. Водой он полностью разлагается на борную кислоту и H2 S.
С азотом бор соединяется только выше 1200 °С. Нитрид бора (BN) представляет собой белый порошок, плавящийся лишь около 3000 °С (под давлением). По кристаллической структуре BN сходен с графитом.
Карбид бора (В4С) образуется в виде черных блестящих кристаллов принакаливании смеси бора (или В2 О3) с углем в электрической печи. Он отличается тугоплавкостью (т. пл. 2550 °С) и чрезвычайной твердостью (близкой к твердости алмаза). И нитрид и карбид бора характеризуются большой устойчивостью по отношению к различным химическим воздействиям.
БОРА НИТРИД, BN, кристаллический, имеет три модификации: гексагональную a-BN, кубическую b-BN (боразон) и ромбоэдрическую g-BN.
Гексагональный нитрид бора альфа-BN.
Кристаллическая структура a-BN состоит из графитоподобных сеток, расположенных, в отличие от структуры графита точно одна под другой с чередованием атомов бора и азота. Белый, похожий на тальк порошок a-BN, получают из элементов при температурах выше 2000 °С. Нитрид бора может быть получен также прокаливанием бора (или B2O3) в атмосфере аммиака или при нагревании смеси B2O3 с восстановителями (углем, магнием) в атмосфере аммиака. По смазочным свойствам a-BN превосходит графит. В спрессованном состоянии нитрид бора обладает полупроводниковыми свойствами, а при наличии небольшого количества примесей обладает люминесцентными свойствами. Нитрид бора при комнатной температуре химически инертен, не реагирует с кислородом или хлором, кислотами или щелочами. Кислород и хлор начинают действовать на него при температурах выше 700 °С. Реагирует с фтором (образуя BF3 и N2) и с HF (образуя NH4BF4); горячие растворы щелочей разлагают его с выделением NH3.
При температуре выше 1000°С начинает разлагаться на элементы.
Алмазоподобная форма бета-BN (боразон).
При давлении выше 62 тыс атм и температурах выше 1350 °С происходит полиморфное превращение графитоподобной гексагональной b-BN модификации в кубическую алмазоподобную b-BN структуру. Хорошими катализаторами такого превращения являются щелочные и щелочноземельные металлы. Как и в случае перехода графит—алмаз, полиморфное превращение сопровождается резким изменением свойств нитрида бора.
Кристаллы боразона, полученные при аллотропическом переходе BN (гекс.) — BN (куб.) при высоких давлениях, имеют вид полиэдров, обычно тетраэдров или октаэдров. Они прозрачны, а их цвет зависит от наличия и типа примесей. Размер образующихся кристаллов боразона зависит от давления и температуры процесса. Избыток бора в реакционной смеси придавал полученным кристаллам боразона коричневый или черный цвет, бериллий — синий, сера — желтый.
Твердость его при оценке по шкале Мооса соизмерима с твердостью алмаза (около 10 баллов), однако боразон сильно превосходит алмаз по термостойкости (до 2000 °С) и ударной прочности.
3.На основе теоретического материала и видео-материалов, выполняем практические задание, выполняем в тетради для практических работ!

 2020-06-29
2020-06-29 468
468








