Тема: Кислотные оксиды.
Дата: 26.05.2020 (1 час)
Цель:
сформировать понятие об оксидах; на примере оксидов закрепить знания о химической номенклатуре для бинарных соединений; изучить химические свойства оксидов; познакомить студентов с основными способами получения оксидов.
Студенты должны знать: оксиды, номенклатура оксидов, кислотный оксид, химические свойства оксидов.
Студенты должны уметь: составлять формулы оксидов, классифицировать оксиды.
План.
1. Оксиды неметаллов.
2. Образование кислот.
3. Кислотные оксиды.
4. Составление формул оксидов.
5. Свойства кислотных оксидов
Опорный конспект
Оксиды - это сложные вещества, состоящие из двух химических элементов, один из которых кислород, с валентность равной 2. Лишь один химический элемент - фтор, соединяясь с кислородом, образует не оксид, а фторид кислорода OF2.
Называются они просто - "оксид + название элемента". Если валентность химического элемента переменная, то указывается римской цифрой, заключённой в круглые скобки, после названия химического элемента.
Оксидынеметаллов
Вы уже знаете, что все вещества делят на две большие группы – органические и неорганические вещества. Изучение классов неорганических веществ мы начнем с группы веществ, которую называют кислотными оксидами. Многие простые вещества – неметаллы при взаимодействии с кислородом образуют оксиды.
Уголь сгорает в атмосфере кислорода с образованием оксида углерода (IV):
С+О2 = СО2
Фосфор тоже горит в кислороде, при этом образуется оксид фосфора (V):
4P + 5O2 = 2P2O5

Рис. 1. Горение фосфора в кислороде
Образование кислот
При растворении полученных оксидов в воде образуются растворы, обладающие общими свойствами. Эти растворы кислые на вкус. В ходе растворения оксида углерода (IV) и оксида фосфора (V) в воде образуются кислоты. Запишем уравнения этих реакций.
При растворении в воде оксида углерода (IV) образуется угольная кислота – Н2СО3:
СO2 + H2O ↔H2CO3
Угольная кислота – нестойкое вещество, она разлагается на исходные вещества. Поэтому правильнее вместо знака равенства поставить знак обратимости в уравнении этой реакции.
Оксид фосфора (V) хорошо растворяется в воде с образованием ортофосфорной кислоты H3PO4:
P2O5+3H2O=2H3PO4
Данные реакции являются реакциями соединения.
Кислотные оксиды
Теперь мы можем объяснить происхождение названия химического элемента кислорода. «кислород» - «рождающий кислоты»: при взаимодействии некоторых неметаллов с кислородом образуются оксиды, растворение которых в воде позволяет получить кислоты.
Оксиды, которым соответствуют кислоты, называют кислотными оксидами.
Например, оксид углерода (IV) и оксид фосфора (V) – кислотные оксиды.
Но не все оксиды неметаллов являются кислотными. Есть оксиды неметаллов, которым не соответствуют кислоты. Среди них, оксид углерода (II) или угарный газ - СО, оксиды азота (I) и (II) – N2O, NO. Этим оксидам кислоты не соответствуют.
Есть еще один интересный факт – не все кислотные оксиды взаимодействуют с водой. Например, оксид кремния (IV) не растворяется в воде. Это вещество составляет основу кварца и белого речного песка. Но оксид кремния является кислотным оксидом, т.к. ему соответствует кремниевая кислота H2SiO3. Это стало известно благодаря тому, что кремниевая кислота разлагается на оксид кремния и воду:
H2SiO3 = SiO2 + H2O
К классу кислотных оксидов относятся не только оксиды неметаллов. Кислотные оксиды могут образовать и некоторые металлы с валентностью более III.
Например, оксид хрома (VI) является кислотным оксидом, т.к. ем соответствует хромовая кислота H2CrO4. Эту кислоту можно получить при взаимодействии оксида хрома (VI) с водой:
CrO3+H2O=H2CrO4
Составление формул кислот, соответствующих оксидам
Не надо заучивать какая кислота какому оксиду соответствует. Чтобы составить формулу кислоты, соответствующей оксиду, надо запомнить несколько правил. Во-первых, валентность химического элемента в оксиде и соответствующей ему кислоте должна быть одинакова.
Валентности элементов в оксиде вы уже умеете определять. Например, в оксиде азота N2O5 валентность азота равна V. Валентности элементов в кислоте, состоящей из трех химических элементов, определить также несложно. Определим валентности элементов в азотной кислоте HNO3.Валентность водорода в кислотах равна I, валентность кислорода равна II. Чтобы найти валентность азота, нужно из общего числа валентностей кислорода вычесть общее число валентностей водорода, т.е. из 6 вычесть 1.
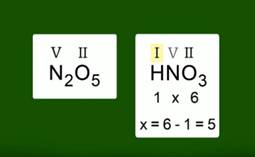
Рис. 2. Валентность азота в N2O5 и HNO3 одинакова и равна V
Формулу кислоты, соответствующей оксиду можно составить, используя реакцию соединения кислотного оксида с водой. Если суммировать атомы одной молекулы оксида и одной молекулы воды, то в большинстве случаев получится формула искомой кислоты.
Рассмотрим два примера. Составим формулы кислот, соответствующих оксиду углерода (IV) и оксиду азота (III). Просуммируем атомы одной молекулы углекислого газа и одной молекулы воды. Получилась формула угольной кислоты H2CO3.
То же проделаем с одной молекулой N2O3 и одной молекулой Н2О. Получили Н2N2O4. В получившейся формуле можно сократить индексы на 2. Получим HNO2 – азотистую кислоту (Рис. 3).
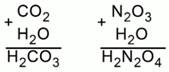
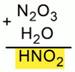
Рис. 3. Составление формул кислот, соответствующих оксидам
Этим правилом нельзя воспользоваться для составления формулы ортофосфорной кислоты. Чтобы ее получить к молекуле оксида фосфора (V) надо прибавить 3 молекулы воды.
Свойства кислотных оксидов
1. Кислотные оксиды, кроме SiО2, реагируют c водой, образуя кислоту: CO2 + H2O → H2CO3
Чтобы составить формулу кислоты, нужно «сложить» все атомы исходных веществ, записывая на первом месте символ водорода, на втором — символ элемента, образующего оксид, и на последнем — символ кислорода. Если индексы получились чётными, их можно сократить: N2O3 + H2O → H2N2O4, или 2HNO2
Эти же реакции можно записать в виде «арифметического примера»:
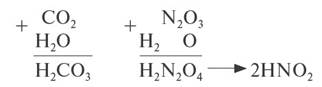
2. Кислотные оксиды реагируют с основными оксидами, образуя соль соответствующей кислоты, т. е. кислоты, которая образуется при взаимодействии этого оксида с водой (см. выше):
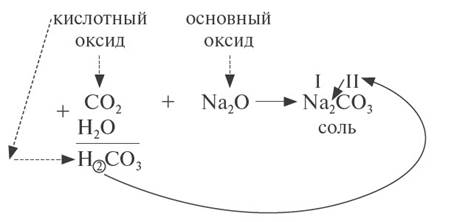
Для того чтобы составить такое уравнение, нужно:
· составить формулу кислоты («прибавив» к молекуле оксида молекулу воды);
· определить валентность кислотного остатка (это часть молекулы кислоты без атомов водорода). В данном случае кислотный остаток имеет состав СО3, его валентность равна числу атомов водорода в кислоте, т. е. II;
· составить формулу соли, записав вместо атомов водорода атом металла из основного оксида с его валентностью (в данном случае — натрий);
· составить формулу соли по валентности металла и кислотного остатка.
3. Кислотные оксиды реагируют с основаниями, образуя соль соответствующей кислоты и воду:
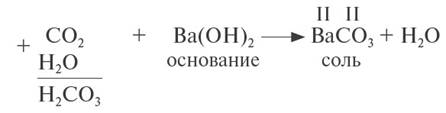
Принципы составления уравнения те же, что и для реакций с основными оксидами (см. пункт 2).
Вопросы для самоконтроля:
1. Что такое оксиды?
2. Какие оксиды называются кислотными?
3. Как назвать оксид?
4. С какими веществами реагируют оксиды?
 2020-06-29
2020-06-29 98
98







