Вам необходимо выполнить задания практической работы
1.Изучите теоретический материл по данной теме:
ХИМИЧЕСКИЕ СВОЙСТВА одноосновных предельных карбоновых кислот
Карбоксильная группа полярная (см. подробно тему "Гомологические ряды карбоновых кислот"), вследствие этого карбоновые кислоты проявляют общие свойства, характерные для всех слабых неорганических кислот. Реакции протекают по так называемому кислотному центру
Реакции по кислотному центру
1. Карбоновые кислоты являются слабыми электролитами, константа диссоциации предельных монокарбоновых кислот уменьшается с увеличением числа атомов углерода в радикале:
RCOOH↔RCOO–+H+
Поэтому растворимые карбоновые кислоты изменяют окраску индикаторов (метилоранжа и лакмуса).
2. Кислоты реагируют с активными металлами:
2CH3COOH+Zn=(CH3COO)2Zn+H2
и с оксидами металлов:
MgO+CH3COOH=(CH3COO)2Mg+H2O
3. Реагируют с сильными основаниями (щелочами), с образованием соответствующих солей:
CH3COOH+NaOH⟶CH3COONa+H2O
4. Реагируют с солями слабых кислот, например, карбонатами (только те кислоты, которые сильнее угольной):
Na2CO3+2HCOOH=2HCOONa+CO2+H2O
Реакции по электрофильному центру
По карбоксильной группе, а именно по электрофильному центру, могут также протекать реакции нуклеофильного замещения. Нуклеофильное замещение у sp2 -гибридизованного атома углерода карбоксильной группы представляет наиболее важную группу реакций карбоновых кислот, по этому механизму карбоновые кислоты могут вступать в реакции с другими органическими веществами, например спиртами, аминами, с другими карбоновыми кислотами и галогенирующими агентами (соединениями фосфора и серы)
Определение
1. Реакция этерификации - это взаимодействие карбоновых кислот со спиртами в присутствии катализаторов - водоотнимающих средств (например, H2SO4 конц.), приводящее к образованию сложных эфиров:
RCOOH+R′OH=RCOOR′+H2O
Механизм реакции этерификации, как нуклеофильного замещения, представлен на схеме:
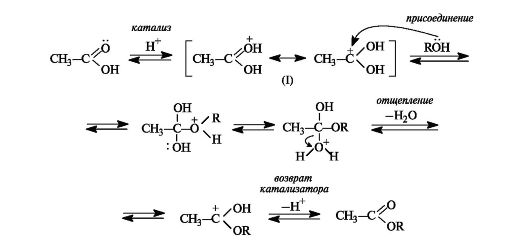
Этерификация - обратимая реакция. Смещение равновесия вправо возможно отгонкой из реакционной смеси образующегося эфира, отгонкой или связыванием воды, либо использованием избытка одного из реагентов. Реакция, обратная этерификации, приводит к гидролизу сложного эфира с образованием карбоновой кислоты и спирта.
2. С другими карбоновыми кислотами реакция также протекает в присутствии водоотнимающих средств и приводит к образованию ангидридов:
RCOOH+R′COOH→P2O5,t∘CRCOOOCR′+H2O
3. С аммиаком или аминами карбоновые кислоты реагируют с образованием амидов кислот:
CH3COOH+NH3→t∘CCH3CONH2+H2O
При действии на карбоновые кислоты аммиака (газообразного или в растворе) сначала образуется аммониевая соль, а при значительном нагревании сухие аммониевые соли теряют воду и превращаются в амиды.
4. Взаимодействие с хлорирующими агентами - хлоридами или бромидами фосфора (V), приводит к замещению гидроксильной группы на галоген и образованию хлорангидридов:
RCOOH+PCl5=RCOCl+POCl3+HCl
Окислительно-восстановительные реакции
Углерод в карбоксильной группе находится в степени окисления +2 и поэтому дальше не окисляется. Восстановление карбоксильной группы может происходить последовательно: сначала с образованием альдегидов и кетонов в присутствии восстановителей.
Ряд свойств карбоновых кислот обусловлен наличием углеводородного радикала, для них возможны реакции замещения. Атомы водорода у второго (углеродного атома весьма подвижны. Поэтому при галогенировании в присутствии каталитических количеств красного фосфора происходит в первую очередь образование 2-галогенкарбоновой кислоты.
CH3−CH2−COOH+Br2→PCH3−CHBr−COOH+HBr
2. Посмотрите видео-материалы, пройдя по ссылкам:

https://youtu.be/JIhtrBC6_Os (Растворение в воде карбоновых кислот);
https://ok.ru/video/3219655267 (Взаимодействие с металлами)
https://youtu.be/vvlWg8NTfUo (Взаимодействие уксусной кислоты с металлами).
 2020-06-29
2020-06-29 343
343







