Лабораторно - практическое занятие № 25.
Тема: «Химические свойства соединений меди, серебра».
Цели занятия:
- совершенствовать знания свойств соединений меди, серебра, золота;
- приобрести навыки выполнения химических реакций, характеризующих свойства соединений меди, серебра;
- проведения качественных реакций на ионы Cu2+, Ag+;
- совершенствовать навыки выполнения опытов получения и исследования свойств комплексных соединений.
I. Теоретическая часть.
Соединения меди. Для меди наиболее характерны соединения со степенью окисления +2, реже +1.
Оксид меди(I) С u 2О— твердое вещество красного цвета, в природе встречается в виде минерала куприта. Практически нерастворимый в воде Си2О имеет слабые амфотерные свойства с преобладанием основных. Он взаимодействует с кислотами и концентрированными щелочами:
Cu2О+ 4НСI = 2Н[С u СI2] + Н2O;
Cu2O + H2SO4 = CuSO4 + Сu + Н2O;
С u 2O + 2NaOH + Н2O = 2Na[Cu(OH)2].
Дигидроксокупрат(I)
натрия
Взаимодействуя с раствором аммиака, Сu2О образует комплексное соединение:
Cu2О + 4NH3 • Н2О = 2[Cu (NH3)2]OH + ЗН2О.
гидроксид
диамминмеди(I)
Гидроксид меди (I) СuОН — очень неустойчивое соединение, легко разлагается:
2CuOH = Сu2O + Н2O.
Оксид меди(II) СuО — порошок черного цвета. Его получают как при взаимодействии меди с кислородом, так и при разложении гидроксида меди(II), нитрата меди(П) и малахита. Он обладает слабыми амфотерными свойствами, т. е. взаимодействует как с кислотами, так и с щелочами. При сплавлении с щелочами образует купраты:
t
2КОН + СuО = К2СuO2 + Н2O.
Аналогично оксиду меди(I) растворяется в водном растворе аммиака:
CuO + 4NH3 • Н2O = [C u (NH3)4](OH)2 + ЗН2O.
гидроксид
тетраамминмеди(II)
Окислительные свойства оксида меди(II) проявляются и при взаимодействии с такими восстановителями, как водород, кокс, оксид углерода(II), которыми он восстанавливается до свободной меди. Оксид меди(II) восстанавливается спиртами, превращая их в альдегиды или кетоны.
Гидроксид меди(II) — осадок голубого цвета, при нагревании легко разлагается:
t
Сu(ОН)2 = СuО +H2O.
Гидроксид меди слабоамфотерен. Он легко растворяется в кислотах, образуя аквакомплекс [Сu(Н2O)4]2+ голубого цвета
Cu(OH)2 + 2НСI + 2HаO = [Сu(Н2O)4]СI2.
Аквакомплекс можно упрощенно записать в виде СuСI2.
В концентрированных растворах щелочи образуется гидроксокомплекс ярко-голубого цвета [Сu(ОН)4]2-:
Cu(OH)2 + 2NaOH = Na2[Cu(OH)4].
Большинство из солей меди(II) хорошо растворимо в воде, но подвержено гидролизу по катиону, поэтому в растворе должен быть избыток кислоты. Наиболее известны сульфат, хлорид и нитрат меди(II), которые применяют в гальваническом производстве.
Под действием восстановителей соли меди(II) в кислотной среде могут восстанавливаться до солей меди(1):
СuСI2 + Сu = 2СuСI;
2CuSO4 + 4KI = 2K2SO4 + 2CuI + I2.
Для меди(II) характерны также комплексные соединения с аммиаком [Cu(NH3)4](OH)2 (фиолетового цвета), [СuСI4]2- (зеленовато-бурого) и др.
В отличие от комплексных соединений меди(I) все комплексные соединения меди(II) в растворе образуют окрашенные ионы.
Ближайший аналог меди серебро представляет собой химически стойкий металл белого цвета. Растворяется серебро в концентр ванной азотной кислоте:
Ag + 2HNО3 = AgNО3 + NО2 + H2О.
Нитрат серебра — белое кристаллические вещество, кристаллизующееся без молекул воды, постепенно темнеющее на свету вследствие образования металла. Светочувствительностью характеризуются и нерастворимые в воде галогениды AgCI, AgBr и AgI применяемые в фотографии.
С кислородом воздуха серебро не реагирует, но вступает в peaакцию с серой и сероводородом, образуя коричнево-черный нерастворимый в воде сульфид Ag2S.
При действии щелочи на раствор нитрата серебра образуетется гидроксид серебра, сразу же отщепляющий воду и превращающиеся в черный оксид:
2AgNО3 + 2NaOH = Ag2O + 2NaNO3 + H2O
Несмотря на незначительную растворимость в воде, жидкость над осадком оксида серебра имеет pH около 11,5. Следовательно, в растворе присутствует сильное основание:

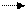 Ag2О + Н2О 5 2Ag+ + 20Н-.
Ag2О + Н2О 5 2Ag+ + 20Н-.
Соединения серебра проявляют сильные окислительные свойства. Различные металлы, включая медь, вытесняют серебро из растворов солей. Нитрат серебра под названием ляпис применяют наружно при накожных язвах, трещинах, остром конъюнктивите Распространенная форма применения — ляписный карандаш (сплав нитрата серебра и нитрата калия).
Контрольные вопросы и задачи:
1. В каких кислотах можно растворить металлическую медь? Составить уравнения реакций. Подобрать коэффициенты методом электронного баланса.
а) HCI (разб.)
б) HCI (конц.)
в) H2SO4 (конц.)
г) HNO3 (разб.)
д) HNO3(конц.)
2. Какие соли меди, мало растворимы в воде? Назвать эти соединения
а) CuCI2
б) CuS
в) Cu SO4
г) Cu(NO3)2
д) (CuOH)2 CO3
3. Какая из приведённых ниже формул отвечает комплексному гидроксиду тетраамминмеди (II), составить уравнение диссоциации.
а) [Cu(NH3)] (OH)2
б) [Cu(NH3)2] OH
в)[Cu(NH3)3] (OH)2
г) [Cu(NH3)4] (OH)2
д) [Cu(NH3)4] OH
4. Каков характер оксида Ag2O, если раствор соли AgNO3 показывает нейтральную реакцию? Ответ обосновать.
а) сильно основной
б) слабо основной
в) амфотерный
г) несолеобразующий
5. Подобрать коэффициенты в уравнении реакции и указать, какой теоретический объём при нормальных условиях займёт NO при растворении 10,8 г. серебра в азотной кислоте:
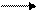 Ag + HNO3 AgNO3 + NO+ H2O
Ag + HNO3 AgNO3 + NO+ H2O
а) 22.4л.; б) 11,2 л.; в) 0,75л.; г) 7,47л.; д) 5,6л.
II. Практическая часть.
Опыт 1. Взаимодействие оксида меди (II) с кислотой.
В пробирку поместите 0,3 г оксида меди (II), добавьте 1 мл серной кислоты. Содержимое пробирки нагрейте до изменения окраски раствора. Какой цвет приобрел раствор? Почему? Составьте уравнение реакции, сделайте вывод о характере оксида меди (II).
Опыт 2. Получение гидроксида меди (II).
В пробирку поместите 4-5 капель раствора щелочи, добавьте 3-4 капли раствора сульфата меди (II). Отметьте наблюдения, укажите агрегатное состояние гидроксида меди (II). Составьте уравнение реакции, сделайте вывод о способе получения.
Опыт 3. Свойства гидроксида меди (II).
Гидроксид меди (II), полученный в предыдущем опыте, разделите на две пробирки. В первую пробирку добавьте 1 мл раствора хлороводородной кислоты. Отметьте наблюдения. Составьте уравнение реакции.
Опыт 4. Разложение гидроксида меди (II) при нагревании.
Выполнение работы: Гидроксид меди (II), полученный во втором опыте, нагрейте. Как изменяется цвет осадка? Отметьте наблюдения. Составьте уравнение реакции. Сделайте вывод о свойствах гидроксида меди (II).
 2020-06-30
2020-06-30 144
144







