3.3.2. Карбонильные соединения. Альдегиды. Кетоны. Карбоновые кислоты. Сложные эфиры.
План.
- Карбонильные соединения: классификация, номенклатура, изомерия.
- Строение карбонильной группы, физические свойства и физиологическое действие альдегидов.
- Химические свойства альдегидов и кетонов.
- Получение, применение альдегидов.
5. Классификация карбоновых кислот. Гомологический ряд предельных одноосновных кислот: номенклатура, изомерия.
6. Строение карбоксильной группы, физические свойства
7. Химические свойства уксусной кислоты.
8. Получение, применение уксусной кислоты.
9. Строение и номенклатура сложных эфиров.
10. Свойства сложных эфиров, применение.
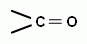
1. К карбонильным соединениям относятся соединения, содержащие карбонильную группу (карбонил, окси-группу).

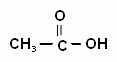
 Эти соединения, в зависимости от связанных с ней заместителей, делятся на две основные группы: альдегиды и кетоны. Альдегиды содержат карбонильную группу, которая связана с первичным атомом углерода, т.е. находится в начале углеродной цепи. Кетоны содержат карбонильную группу, которая связана со вторичным атомом углерода, т.е. находится в середине углеродной цепи. Карбоновые кислоты кроме карбонильной группы имеют еще и гидроксогруппу, причем обе функциональные группы связаны с одним (первичным) атомом углерода. Кислоты тоже относят иногда к карбонильным соединениям.
Эти соединения, в зависимости от связанных с ней заместителей, делятся на две основные группы: альдегиды и кетоны. Альдегиды содержат карбонильную группу, которая связана с первичным атомом углерода, т.е. находится в начале углеродной цепи. Кетоны содержат карбонильную группу, которая связана со вторичным атомом углерода, т.е. находится в середине углеродной цепи. Карбоновые кислоты кроме карбонильной группы имеют еще и гидроксогруппу, причем обе функциональные группы связаны с одним (первичным) атомом углерода. Кислоты тоже относят иногда к карбонильным соединениям.
Рассмотрим сначала альдегиды и кетоны. В зависимости от природы углеродного радикала различают алифатические и ароматические карбонильные соединения, а также предельные и непредельные.





Функциональная группа у альдегидов находится на конце углеродной цепи, у первичного атома углерода. У альдегидов она является главной функциональной группой и счет атомов идет от нее. Карбонильная группа в названии альдегида обозначается добавлением суффикса –аль. Цифра в названии не указывается, ведь это всегда первый атом углерода. Т.е. изомерии положения функциональной группы для альдегидов нет. Возможна только изомерия углеродного скелета и межклассовая изомерия с кетонами. У кетонов оксо-группа указывается добавлением суффикса –он. Кроме того, надо указать, где находится эта группа. Эта цифра должна быть как можно  меньше.
меньше.
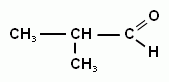
 Например:
Например:
 Метаналь (формальдегид, муравьиный альдегид) Этаналь (ацетальдегид, уксусный альдегид)
Метаналь (формальдегид, муравьиный альдегид) Этаналь (ацетальдегид, уксусный альдегид)
 2-метилгексанон-3.
2-метилгексанон-3.
Пропаналь (пропионовый альдегид)
Пропанон

 Бутаналь (масляный альдегид)
Бутаналь (масляный альдегид)
Метилпропаналь
Физические свойства.
Карбонильные соединения не образуют водородных связей, поэтому температуры кипения у них ниже, чем у соответствующих спиртов. Метаналь – газ (кипит при -210С), все другие низшие альдегиды – жидкости, высшие – твердые вещества. Низшие альдегиды летучи и имеют характерный запах. Они растворимы в воде. Водный 40% раствор метаналя называют формалином. Этаналь летучая жидкость (температура кипения 210С), с неприятным удушливым запахом (в малых концентрациях он пахнет яблоками). Простейшим кетоном является ацетон (диметилкетон, пропанон): бесцветная жидкость с характерным запахом, хорошо растворим в воде, сам хороший растворитель.
Физиологическое действие. Формальдегид ядовит, вызывает денатурацию белков, легко окисляется в организме и превращается в сильную муравьиную кислоту. Это исходное вещество для получения ряда лекарственных препаратов (например, уротропина). Уротропин можно использовать также в качестве сухого горючего. Ацетальдегид тоже ядовит. Он является продуктом неполного окисления этанола в организме человека и именно с ним связаны тяжелые последствия алкогольного отравления. Ацетон – один из продуктов метаболизма жирных кислот в организме человека. Его повышенная концентрация в крови и моче характерна при отравлении, тяжелых случаях диабета, при токсикозах и голодании. Повышение концентрации ацетона нарушает работу нервной системы.
Особенности строения карбонильной группы.  Атом углерода карбонильной группы находится в состоянии sp2 гибридизации и образует три
Атом углерода карбонильной группы находится в состоянии sp2 гибридизации и образует три  -связи, лежащие в одной плоскости под углом 1200 и одну
-связи, лежащие в одной плоскости под углом 1200 и одну  -связь с атомом кислорода, за счет негибридной р-орбитали. Причем связи между атомами углерода и кислорода сильно поляризованы. В результате на атоме углерода образуется частичный положительный заряд, и он становиться удобным объектом для атаки нуклеофила. Эта атака для альдегидов приводит к реакции присоединения (АN). В зависимости от природы радикала, связанного с карбонильной группой, величина заряда на атоме углерода может быть разной, т.е. альдегиды вступают в реакцию присоединения с разной активностью.
-связь с атомом кислорода, за счет негибридной р-орбитали. Причем связи между атомами углерода и кислорода сильно поляризованы. В результате на атоме углерода образуется частичный положительный заряд, и он становиться удобным объектом для атаки нуклеофила. Эта атака для альдегидов приводит к реакции присоединения (АN). В зависимости от природы радикала, связанного с карбонильной группой, величина заряда на атоме углерода может быть разной, т.е. альдегиды вступают в реакцию присоединения с разной активностью.
Химические свойства.
1) Альдегиды - один из наиболее легко окисляющихся классов органических соединений. При этом обычно образуются соответствующие карбоновые кислоты. А окисление в жестких условиях или очень сильным окислителем приведет к образованию углекислого газа.
Полное окисление:
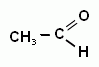
+ О2 → СО2 + Н2О
Реакция «серебряного зеркала» (р. Толленса) – с аммиачным раствором нитрата серебра (обычно вместо формулы комплексного соединения серебра в уравнении пишут формулу оксида серебра). Образуется соответствующая карбоновая кислота и свободное серебро, которое выделяется в виде черного осадка или блестящей (зеркальной) пленки на поверхности сосуда.
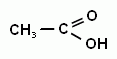

+ Ag2O → + Ag↓
Реакция «медного зеркала» (р. Фелинга) – реакция окисления альдегидов комплексным соединением меди (II) (обычно вместо формулы комплексного соединения меди в уравнении пишут формулу гидроксида меди (II). Образуется соответствующая карбоновая кислота и оксид меди (I) оранжевого цвета. Эти реакции окисления (с оксидом серебра и с гидроксидом меди) используют как качественные на альдегиды.
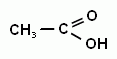

+ Cu(OH)2↓ → + CuOH↓
Cu(OH)↓ → Cu2O↓ + H2O
Можно использовать как качественную реакцию на альдегиды и реакцию с фуксинсернистой кислотой. В этом случае мы наблюдаем изменение окраски раствора в характерный розовый цвет.
Для написания реакций окисления очень удобно пользоваться «дорогой ОВР», по которой в основном и протекают эти реакции. В процессе реакции обычно окисляется только углерод функциональной группы, а углеродная цепь не подвергается изменениям. Из первичных спиртов легко образуются альдегиды, а они легко окисляются до карбоновых кислот. Но при образовании карбоновых кислот из кетонов (т.е. на третьей стадии окисления) цепь начинает разрываться, потому что углерод карбоксильной группы должен быть первичным. Поэтому кетоны в целом менее активны, чем альдегиды. Окисление кетонов проходит аналогично окислению альдегидов, но в более жестких условиях и сопровождается разрывом углеродной цепи и образованием нескольких карбоновых кислот. Окончательное разрушение углеродного скелета происходит только на последней стадии, при образовании углекислого газа.
Углеводород (0) ↔ спирт (1) ↔ альдегид (2) ↔ карбоновая кислота (3) ↔ СО2 (4)
2) Для карбонильной группы характерны реакции нуклеофильного присоединения с разрывом двойной связи. Такие реакции присоединения протекают для альдегидов с разными веществами.

Например,к реакциям присоединения (АN) относитсяреакция гидрирования (т.е. присоединения водорода).Эту реакцию можно рассматривать как реакцию восстановления альдегидов и кетонов.Из кетонов образуются вторичные спирты, а из альдегидов – первичные.

+ H2 → CH3-CH2-OH
Можно сделать вывод: карбонильные соединения легко окисляются и восстанавливаются.
спирт ↔ альдегид ↔ карбоновая кислота
Очень важной является реакция присоединения спиртов к альдегидам. При этом образуются полуацетали, а потом полуацетали при взаимодействии со спиртами превращаются в ацетали (но это уже реакция нуклеофильного замещения). Такие реакции протекают в живых организмах с углеводами.

Ш. Для карбонильной группы возможны и реакции полимеризации с разрывом двойной связи. Их можно рассматривать как результат нуклеофильной атаки кислородным атомом одной молекулы карбонильного атома другой молекулы. Например, молекулы уксусного альдегида вступают в реакцию друг с другом, при этом углеродная цепочка становится длиннее (альдольная поликонденсация). Особенно характерна такая реакция для формальдегида. Например, при хранении формалина (40% раствор формальдегида) образуется белый осадок – параформ.

Кроме того, при длительном хранении формальдегид, даже в водных растворах, способен к реакции диспропорционирования (реакция Канниццаро).
2СН2О + Н2О → СН3ОН + НСООН, и раствор приобретает кислую реакцию.
Очень важной для современной промышленности является реакция поликонденсации формальдегида с фенолом. При этом образуется фенолформальдегидная смола.
 2020-07-01
2020-07-01 263
263







