МИНИСТЕРСТВО ОБРАЗОВАНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Биологический факультет
Кафедра биохимии
Биогенез мембран. Внутриклеточный транспорт и обновление мембранных липидов и белков.
Студентки 4 курса 4 группы
Бойко М. С.
Преподаватель:
Орел Н. М.
Минск 2012
СОДЕРЖАНИЕ
ВВЕДЕНИЕ………………………………………………………………..................3
ГЛАВА 1. Биогенез мембран и метаболизм мембранных липидов…………………………………………………………………….9
ГЛАВА2. Внутриклеточный транспорт ………………………………………..12
2.1. Внутриклеточный транспорт липидов…………………………………… 12
2.2 Внутриклеточный транспорт холестерина....................................................13
2.3. Внутриклеточный транспорт фосфолипидов…………………………….14
2.4. Внутриклеточный транспорт мембранных белков…………………….17
2.5. Сборка мультисубъединичных комплексов и обновление мембранных белков………………………………………………………………………………20
Список используемой литературы………………………………………………22
ВВЕДЕНИЕ
В клетке происходит непрерывный синтез компонентов мембран, сборка элементов мембран и целых мембранных структур. В клетках печени теплокровных животных полупериод жизни плазматической мембраны составляет 2—3 дня, внешней мембраны митохондрий — 5—6 дней, внутренней — 8—10 дней. Наиболее быстро обновляются мембраны эндоплазматического ретикулума печени — полупериод их жизни составляет всего 1—2 дня. Биогенез биологических мембран является наиболее существенным моментом развития, и дифференциация клеток в первую очередь связана с изменением их мембранных структур.Совсем недавно достигнут большой прогресс в понимании общих принципов переноса белков через мембраны митохондрий, эндоплазматического ретикулума и грамотрицательных бактерий. Эти экспериментальные системы изучались наиболее интенсивно. И хотя между соответствующими процессами есть значительные различия, они имеют ряд общих особенностей.
1. Существует идентифицируемая часть полипептидной последовательности, которая служит участком узнавания, или «сигналом», направляющим отдельный полипептид к мембране, в которую он встраивается. Эти сигнальные участки часто расположены на N-конце новосинтезированного полипептида и отщепляются специфическими сигнальными пептидазами после встраивания его в нужную мембрану или переноса через нее. Для обозначения N-концевого сигнала различными авторами использовались следующие термины: сигнальный пептид, сигнальная последовательность, транзитный пептид, лидирующий пептид, препоследовательность.
2. Процессы трансляции и встраивания белков в мембрану можно разделить в эксперименте. Для сборки мембранных белков в большинстве случаев необходима энергия, отличающаяся по величине от той, которая требуется для их трансляции на рибосоме. Замечено, что in vivo трансляция и перенос часто бывают тесно сопряжены во времени.
3. Связавшийся с мембраной-мишенью полипептид должен, кроме того, находиться в конформации, в которой может осуществляться его перенос через мембрану или встраивание в нее. Во многих случаях перенос белков через мембраны происходит от N-конца к С-концу, при этом необходимо, чтобы белок был по крайней мере частично развернут или слабо свернут. Полипептид может транспонироваться в вытянутой форме в ходе энергозависимого процесса.
На рис.1 представлена схема, иллюстрирующая всю сложность этой проблемы и суммирующая данные по эукариотическим клеткам и грамотрицательным бактериям. Доставка каждого белка к месту назначения обеспечивается иерархией сигналов, закодированных в каждом полипептиде. Например, большинство белков, предназначенных для эндоплазматического ретикулума или митохондрий, синтезируется в виде предшественников большей молекулярной массы; на N-конце у них имеется дополнительная последователь-

ность, которая отщепляется особыми протеолитическими ферментами, имеющимися в этих органеллах. Такие первичные сигналы весьма разнообразны и необходимы для того, чтобы полипептиды были унизаны при транслокации специфическими рецепторами в этих органеллах. Связывание с митохондриями происходит сразу после завершения трансляции. Однако для большинства белков, направляемых в эндоплазматический ретикулум в клетках млекопитающих, наблюдается иная картина. Как видно из рис. 10.1, после связывания белков с соответствующей органеллой должна произойти дальнейшая сортировка. Для этого нужна дополнительная информация, которая также должна быть закодирована в каждой полипептидной последовательности и может рассматриваться как вторичные сигналы. В нескольких случаях их удалось идентифицировать как сигнальные последовательности, физически отделенные от первичных, хотя, возможно, так бывает не всегда.
| А Линейное проталкивание 6 Образование петли через канал N |
| В. Самопроизвольное встраивание одиночной спирали,спиральной шпильки или частично свер -и нутого "домена встраивание" |
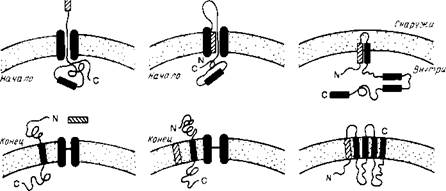
Рис..2. Три общие модели возможной сборки белков в мембране. Две первые (А и Б) предполагают, что белок транспортируется в линейной форме через некий белковый канал. При наличии стоп-сигнала процесс останавливается, в противном случае через мембрану проходит весь белок. Модель В предполагает, что гидрофобные элементы полипептида самопроизвольно включаются в липидный бислой. Гидрофобный элемент может представить собой одиночную спираль или более сложную структуру. Процесс может быть опосредован белками.
Особый интерес для нас представляет процесс сборки мембранных белков, который целесообразно рассмотреть в связи с их сортировкой. На рис. 2 схематически показаны три общих механизма проникновения пептидного предшественника в мембрану. Механизмы А к Б являются вариантами схемы линейного вытеснения, согласно которой сигнальная последовательность направляет полипептид к переносящему устройству, которое включает в себя заполненный водой канал. Сигнальная последовательность может проходить прямо сквозь канал или оставаться связанной с мембраной, образуя, как показано на рис.2, петлю. В отсутствие какого-либо сигнала остановки процесса переноса полипептид будет транспортироваться через мембрану целиком. Однако, если внутри полипептида имеется второй сигнальный пептид, называемый стоп-сигналом переноса, то процесс останавливается и стоп-сигнал переноса становится трансмембранным сегментом зрелого мембранного белка. Фиксируя белок в мембране, стоп-сигнал переноса действует как сигнал сортировки. Если в белке имеются и другие сигналы начала и конца переноса, то будут образовываться следующие трансмембранные сегменты.
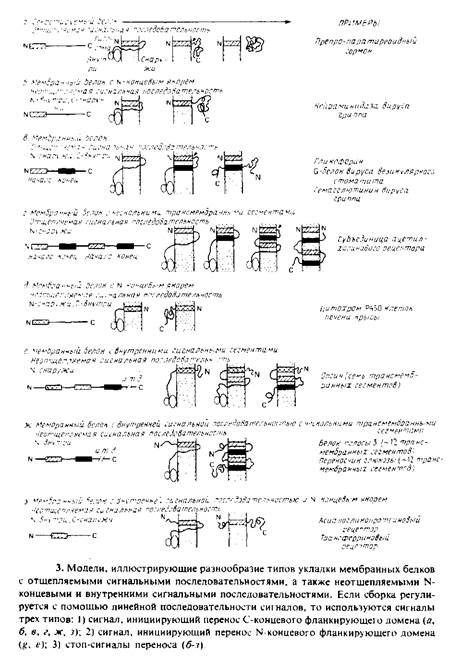
Рис. 10.3 показывает, как сочетание нескольких видов сигналов может направлять последовательность реакций таким образом, чтобы создавалось широкое разнообразие типов упаковки встраиваемых в мембрану белков эндоплазматического ретикулума. Заметим, что сигнальные последовательности, которые не удаляются протеолитиче-ским путем, остаются в начале трансмембранных сегментов и могут использоваться для инициации транспорта фланкирующих полнопептидных доменов на N- или С-конце. К сожалению, эта простая схема не является исчерпывающей, известны примеры, когда сигналы изменяют свою функцию в зависимости от обстоятельств или когда в правильном включении в мембрану существенную роль играют взаимодействия между предполагаемыми сигналами внутри полипептида.
Схема В на рис.2 иллюстрирует возможную роль самопро-извольного включения в мембрану гидрофобных элементов полипептидного предшественника. Этот механизм может реализовываться только тогда, когда включение в мембрану происходит после трансляции полипептида. Первым примером, подтверждающим существование этого механизма, является пробелок оболочки фага М13. Модель самопроизвольного включения может использоваться для объяснения механизма встраивания поперек мембраны амфифильных а-спиралей или 0-структур. Этот процесс может также, конечно, быть белокзависимым.
О координации биосинтеза мембранных липидов и белков в про карнотитеских или эукариотических клетках известно немного. Установлено, впрочем, что в нескольких случаях сверхпродукция отдельных мембранных белков приводит к разрастанию внутриклеточных мембран, содержащих липиды и в преобладающем количестве — сверхпродуцированный белок. То обстоятельство, что пипидный состав разнообразных мембран в эука-риотической клетке существенно различается, позволяет задаться вопросом, как эти композиции липидов создаются и поддерживаются. Мы остановимся, в частности, на скорости обмена разных видов липидов между мембранами и возможных механизмах, облегчающих перенос липидов от места их синтеза к месту назначения. Наконец, известно, что липидный состав мембран многочисленных организмов варьирует при изменении внешних условий.
ГЛАВА 1. БИОГЕНЕЗ МЕМБРАН И МЕТАБОЛИЗМ МЕМБРАННЫХ ЛИПИДОВ
Фосфолипиды — основные компоненты биомембран. Они непрерывно синтезируются в эндоплазматическом ретикулуме и аппарате Гольджи. Холестерин синтезируется в эндоплазматическом ретикулуме, а также доставляется в клетки с помощью опосредованного рецепторами эндоцитоза.
Синтез фосфатидилэтаноламина и фосфатидилхолина, осуществляющийся с помощью этанола мин- и холинфосфодиэстеразы, протекает как в эндоплазматическом ретикулуме, так и в аппарате Гольджи. Однако около 90% активности этих ферментов в клетках печени локализовано в эндоплазматическом ретикулуме и только 1% — в аппарате Гольджи. В очищенной плазматической мембране клеток печени активность этого фермента не обнаружена. Синтез фосфатидилинозитола идет в микросомной фракции печени и мозга, тогда как синтез фосфатидилглицерина и кардиолипина происходит в митохондриях, где эти липиды преимущественно и локализуются.
В процессе превращения фосфатидилсерина в фосфатидил- этаноламин в митохондриях, а также при синтезе сфингомиелина с помощью переноса фосфохолиновой группы от фосфатидилхолина к церамиду в плазматической мембране в качестве субстратов используются фосфолипиды, синтезированные ранее в эндоплазматическом ретикулуме. Таким образом, внутриклеточный транспорт липидов — важнейший процесс биогенеза клеточных мембран.
Липиды доставляются не только к определенным органеллам,. но и встраиваются в соответствующий монослой мембраны, обусловливая ее асимметричность. Асимметричность мембран определяется не только различием фосфолипидного состава внешнего и внутреннего слоев, но и различной насыщенностью жирнокислотных остатков, входящих в состав этих фосфолипидов.
Эндоплазматический ретикулум поставляет липиды всем органеллам клетки и плазматической мембране. Ферменты, включающиеся в финальную стадию биосинтеза фосфатидилхолина и фосфатидилэтаноламина, локализованы на цитоплазматической поверхности микросомных везикул, выделяемых из клеток печени крыс. Последующие исследования показали, что синтез фосфати- дилсерина и фосфатидилинозита также локализован на этой поверхности. Поскольку липиды эндоплазматического ретикулума органи-зованы в бислои, то, естественно, возникает вопрос, как синтезированные на внешней поверхности бислоя липиды транспортируются на внутреннюю сторону мембраны.
Изучение трансмембранного перемещения липидов шло в трех направлениях.
1. Изучение липидных везикул. Было показано, что время полуобмена липидов между наружным и внутренним слоями очень велико и не может иметь физиологического значения.
2. Исследование мембран эритроцитов и микросомных везикул показало, что обмен липидов в нативных мембранах между внутренним и внешним слоями происходит достаточно медленно (в течение нескольких часов). Позднее было продемонстрировано, что в быстро растущих клетках (микросо- мальная фракция бактерии Bacillus megaterium) полуобмен липидами между различными сторонами мембраны происходит в течение нескольких минут. Отсутствие сколь значительного транс-мембранного переноса липидов в везикулах, полученных из мембранных фосфолипидов, позволило предположить необходимость специального фермента «флиппазы». Существование такого фермента было постулировано Бретчером в 1978 г.
3. Исследования, направленные на по иск этого гипотетического фермента — переносчика липидов, способов регистрации его активности. Сравнение скорости трансмембранного переноса диглицерида (очень быстрая) со скоростью обмена соответствующего фосфатидилдиглицерина (очень медленная) позволило предположить, что в движении через мембрану основным препятствием служат гидрофильные полярные группы фосфолипидов. Было выдвинуто предположение, что «флиппаза» облегчает транспорт полярных группировок через мембрану.
В.Р. Бишоп и Р.М. Бели в 1984 г. нашли в микросомных мемб-ранах печени крыс переносчик для водорастворимых короткоцепочечных фосфолипидов. Транспорт этих липидов не регистрировался в клетках крови и липидных везикулах, а в микросомах был весьма чувствителен к действию протеолитических ферментов и обработке N-этилмалеимидом. Интересно, что этот транспортный белок различал изомеры зп-1,2-фосфатидилхолин;
sn-2,3-фосфатидилхолин, перенося их через микросомальиую мембрану с различной скоростью.
В настоящее время «флиппаза» не выделена в чистом виде и, несмотря на ряд экспериментов, подтверждающих существование этого переносчика, остается гипотетическим ферментом. Недавно было показано, что транспорт аминосодержащих фосфолипидов :через эритроцитарную мембрану требует энергии АТФ. Возможно, что «флиппазы» представляют новый вид АТФаз.
 2020-07-01
2020-07-01 392
392







