Фенолы
План:
1. Oпределение. Классификация.
2. Номенклатура. Изомерия.
3.Одноатомные фенолы, физические и химические свойства.
4. Отдельные представители одноатомных фенолов. Фенол, пикриновая кислота, тимол.
5. Двухатомные фенолы: резорцин, гидрохинон, пирокатехин, адреналин.
Мотивация: на занятии по теме «Фенолы» изучаются вопросы: классификация, заместительная и тривиальная номенклатура, структурная изомерия, физические и химические свойства, применение в медицине. Фенол (карболовая кислота) обладает сильной бактерицидной активностью, растворы применяют для дезинфекции больничных предметов обихода, белья, выделений, фенол входит в препарат «Фукорцин» - антигрибковое средство. Трикрезол - смесь орто-, мета- и пара – крезолов, используют как дезинфицирующее средство и консервант инъекционных растворов. Резорцин применяют при кожных заболеваниях. Адреналин – гормон мозгового слоя надпочечников, синтезируется в организме человека.
Фенолы – производные ароматических углеводородов, получающихся из аренов в результате замещения одного или нескольких атомов водорода в ядре гидроксильными группами.

В зависимости от числа ОН-групп в бензольном кольце, бывают: одно-, двух и трёхатомные.
Номенклатура и изомерия. При построении названий фенолов атомы углерода в бензольном кольце принято обозначать от 1 до 6, начиная с углерода, связанного с ОН-группой (номенклатура схожа с ароматическими углеводородами). Цифрами и приставками указывают положение и число заместителей, с добавлением основы – фенол.
Например:

3,5-диметилфенол 4-этилфенол
Часто для фенолов разной степени замещенности употребляют тривиальные названия. (резорцин, гидрохинон, пирокатехин, крезолы- это метилфенолы, или гидрокситолуолы.)
Примеры:
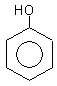 | 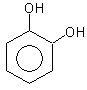 |  |
| Гидроксибензол (фенол) | 1,2-дигидроксибензол (пирокатехин) | 1,3-дигидроксибензол (резорцин) |
 |  |  |
| 1,4-дигидроксибензол гидрохинон. | 1,2,3-тригидроксибензол Пирогаллол | 1,3,5-тригидроксибензол флороглюцин |
ИЗОМЕРИЯ. Монозамещенные фенолы могут существовать в виде трех структурных изомеров (орто,- мета-, пара-),в многоатомных фенолах обусловлена положением ОН-групп.
Способы получения.
1) Выделение из продуктов сухой каменноугольной смолы, а также из продуктов пиролиза бурых углей и древесины (деготь).
2) Через бензолсульфокислоту. Сначала бензол обрабатывают при нагревании концентрированной серной кислотой
C6H6 + H2SO4 = C6H5SO3H + H2O
Полученную бензолсульфокислоту сплавляют со щёлочью
C6H5SO3H + 3NaOH = C6H5ONa + 2H2O + Na2SO3
После обработки фенолята сильной кислотой получают фенол.
3) Синтетический путь получения фенола - кумольный метод из изопропилбензола:

(кумол) гидроперекись фенол ацетон
4)Гидролиз хлорбензола (SN):

Условия протекания реакции: а) давление, температура 300-350оС, автоклав; б) катализатор - соль Сu +8% p-p NaOH
Физические свойства. Фено́л представляет собой бесцветные игольчатые кристаллы, розовеющие на воздухе из-за окисления, приводящего к окрашенным продуктам. Обладают специфическим запахом гуаши. Растворим в воде (6 г на 100 г воды), в растворах щелочей, в спирте, в бензоле, в ацетоне. Является сильным антисептиком, за счет денатурирующих белки свойств (образования межмолекулярных водородных связей). Ядовит. Является антисептиком, при попадании на кожу вызывает ожоги. С водой образует гидрат, называемый карболовой кислотой.
Химические свойства фенолов
Строение молекулы фенола. Бензольное кольцо и ОН-группа, объединенные в молекуле фенола, влияют друг на друга, взаимно повышая реакционную способность друг друга. Фенильная группа оттягивает на себя неподеленную электронную пару от атома кислорода в ОН-группе, увеличивается поляризация связи О-Н

В результате на атоме Н этой группы увеличивается частичный положительный заряд (d+), полярность связи О–Н возрастает, что проявляется в увеличении кислотных свойств этой группы. В сравнении со спиртами, фенолы представляют собой более сильные кислоты. В молекуле фенола неподеленные электронные пары кислорода вступают во взаимодействие (сопряжение) с π-электронами бензольного кольца. ОН-группа является электродонором, электронная плотность повышена в орто и пара положениях. Эти реакционные точки могут атаковаться электрофильными реагентами, («любящими электроны»). Пара электронов атома кислорода, оттянутая к бензольному кольцу, увеличивает прочность связи С–О, поэтому реакции, протекающие с разрывом этой связи, характерные для спиртов, для фенолов возможны, но не типичны.
Для фенолов возможны два типа превращений:
1) замещение атома водорода в ОН-группе.
2) замещение водородных атомов бензольного кольца.
3) замещение ОН-группы не совсем типично.
 2020-07-01
2020-07-01 937
937







