Обычно эфиры называют по тем радикалам, которые входят в их состав и добавляют «оловый эфир». CH3 – O–C2H5- метилэтиловый эфир, CH3-O-CH3 – диметиловый эфир.
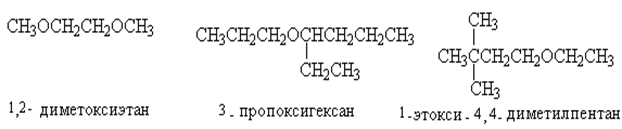
По международной номенклатуре ИЮПАК эфиры рассматривают как алкоксиалканы, т.е производные углеводородов, в которых атом водорода замещен алкоксигруппой R- O -: CH3 – O метоксигруппа C2H5– O этокси C6H5O- фенокси. Название простого эфира строится следующим образом: к названию старшего (наиболее длинного) углеводородного радикала прибавляют в качестве префикса название алкоксигруппы или арилоксигруппы.CH3 – O–C2H5 метоксиэтан C8H17-O-C6H5 феноксиоктан.
 Применяются тривиальные названия: анизол = метоксибензол.
Применяются тривиальные названия: анизол = метоксибензол.
Изомерия зависит от строения радикала, которые могут иметь прямую или разветвленную цепь. Характерна и метамерия - разновидность структурной изомерии, которая обусловлена длиной цепи радикала. (Диэтиловый и метилпропиловый эфир)
Способы получения
Методы получения простых эфиров: межмолекулярная дегидратация спиртов и реакции Вильямсона (взаимодействие алкоксидов с галогеналканами)
Межмолекулярная дегидратация спиртов
Это наиболее старый способ получения простых эфиров пригоден для получения симметричных простых эфиров из неразветвленных первичных спиртов.
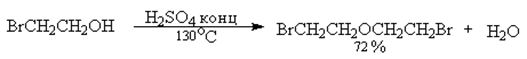
Третичные спирты в этих условиях образуют алкены в результате внутримолекулярной дегидратации.
Синтез простых эфиров по Вильямсону заключается во взаимодействии алкилгалогенидов с алкоголятами щелочных металлов . Так можно получать как симметричные, так и несимметричные эфиры.
(CH3)3CO-K + Br- CH2 CH3 → (CH3)3 CO- CH2CH3 + KBr
Получили 1-этокси-1,1-диметилэтан.
Физические свойства
Первые два представителя эфиров – диметиловый и метилэтиловый эфир при обычных условиях - газы. Начиная с диэтилового эфира – бесцветные легко подвижные жидкости. Простые эфиры легче воды и почти не растворяются в ней. Растворяются в органических растворителях.
Химические свойства.
В химическом отношении простые эфиры характеризуются высокой инертностью по отношению ко многим реагентам: не взаимодействуют с металлическим натрием, щелочами, кислотами, водой не гидролизуются.
1. Образование оксониевых солей.
Эфиры растворяются в концентрированных протонных кислотах с выделением теплоты. Образуются непрочные соединения солеобразного типа - оксониевые соединения. У эфирного атома кислорода имеется пара не поделённых электронов: протон кислоты образует с этой парой связь (донорно-акцепторная связь), в результате возникает непрочный положительно заряженный ион оксония.
R→O←R + H2SO4 → [R2 →O: H]+ HSO4 - гидросульфат диэтилоксония.
2.Реакции расщепления простых эфиров под действием серной, иодоводородной, бромоводородной кислот.
Простые эфиры расщепляются при нагревании концентрированными HBr или HI с образованием галогеналканов.
CH3 – O–C2H5 + HI → CH3I + C2H5I + H2O
На холоду иодоводородная кислота разлагает с образованием галогеналкана и спирта.
CH3 – O–C2H5 + HI → CH3I + C2H5ОН.

Концентрированная серная кислота разлагает простые эфиры, с образованием сложного эфира серной кислоты и спирта.
C2H5 – O–C2H5 + H2SO4 → C2H5 – O- SO3H + C2H5OH
Этилсерная кислота + Этанол
3.Реакции окисления.
Простые эфиры проявляют повышенную склонность к автоокислению в присутствии кислорода с образованием перекисей

и гидроперекисей эфиров, за счет окисления в α-положении к эфирному кислороду.
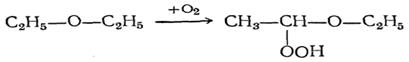
Аутоокисление эфиров представляет большую опасность при работе с эфирами, поскольку гидроперекиси, накапливаются, могут детонировать при слабом нагреве. Проба на наличие пероксидных соединений производится раствором иодида калия. Если содержится, то иодид калия окисляется до свободного иода, окрашивающий раствор в буро-коричневый цвет иода. Небольшое количество иода обнаруживают, добавив в пробу раствор крахмального клейстера, который образует с иодом соединение синего цвета
4. Радикальные реакции простых эфиров
Подобно алканам простые эфиры вступают в реакции радикального замещения, галогенирование эфиров осуществляется в a-положение по отношению к атому кислороду.

Димедрол = дифенгидрамин( β-диметиламиноэтилового эфира бензгидрол.) Лекарственный препарат, относящийся к классу простых эфиров.
Наиболее характерной для димедрола является реакция образования окрашенных оксониевых солей с концентрированными кислотами. Так, при действии на димедрол концентрированной серной кислоты образуется оксониевая соль от желтого до кирпично-красного цвета. При добавлении воды окраска исчезает, что связано с разложением этой соли.
Димедрол + Н2SО4 -----> димедролоксония гидросульфат
Составьте конспект лекции и ответьте на вопросы:
1) Какая реакция указывает на то, что фенол является кислотой:
А) C6H5OH + Br2 ® Б) C6H5OH + NaOH ®
В) C6H5OH + HNO3 ® Г) C6H5OH + CH3Cl ®
2) Кислотные свойства ярче выражены у:
А) этанола Б) фенола
В) метанола Г) ацетилена
3) Какое из веществ образуется при взаимодействии фенола с бромной водой?
А) 2,4,6 – трибромфенол Б) бромбензол
В) 3 – бромфенол Г) 2 – бромтолуол
ОТВЕТЫ:
| 1 | 2 | 3 |
4) Составьте структурные формулы простых эфиров, дайте им название по заместительной номенклатуре:
а) метилфениловый эфир
б) октилфениловый эфир
в) пропилэтиловый эфир
 2020-07-01
2020-07-01 631
631







