Белки
Теория
Перечень вопросов, рассматриваемых в теме:
Определение
Классификация белков
Строение белковых молекул.
Физические свойства
5. Функции белков
Свойства белков
Знаете ли Вы:
1. Белок никогда не переходит в жир – совет врача-диетолога.
2. Образование морщин связано с уменьшением натурального белка коллагена и
впрыскиванием его в верхний слой кожи коллаген возмещается. Почти все мелкие и крупные морщины можно корректировать этой терапией – совет врача-косметолога.
3. Современное название белков-ферментов – энзимы.
4. Выработка иммунитета – это важная защитная функция белка. Диета снижает иммунитет.
5. Изучение белков позволило ответить на вопросы, почему одни люди высокого роста, а другие низкого, одни полные, другие худые, одни медлительные, другие проворные, одни сильные, другие слабые.
6. Все белки в организме человека постоянно разрушаются и синтезируются. Период полураспада белков в теле человека 80 дней, в мышцах, коже, мозгу – 180 дней, в сыворотке крови и печени – 10 дней, у ряда гормонов он исчисляется часами и даже минутами (инсулин).
7. Каждый вид обладает собственными видами белков. Если бы в белке не было бы заложено этого качества, то не было бы такого разнообразия жизненных форм, к которым относимся и мы.
Понять, каким образом белки осуществляют перечисленные выше многообразные функции, непросто. Единственный способа – узнать, из чего построен белок, как расположены структурные элементы, составляющие его молекулу, по отношению друг к другу и в пространстве, как они взаимодействуют друг с другом и веществами внешней среды, т.е. изучить строение и свойства белков.
Определение
Белки являются обязательной составной частью любого живого организма и играют важнейшую роль в обеспечении процессов жизнедеятельности.
В состав белков обязательно входят четыре химических элемента: углерод, водород, кислород и азот. Многие белки содержат серу. В состав некоторых входит фосфор. Есть белки, содержащие атомы металлов.
Белки — природные высокомолекулярные вещества (полимеры), состоящие из остатков аминокислот.
Белки – биополимеры, мономерами которых являются α - аминокислоты.
α - Аминокислоты - производные карбоновых кислот, у которых один водородный атом, у α- углерода, замещен на аминогруппу (-NH2) (рис. 1).
α
R – CH - COOH
I
NH2
Рис. 1. Общая формула аминокислоты.
Классификация белков
В зависимости от химического состава белки разделяют на простые и сложные.
Простые (протеины) состоят из аминокислотных остатков.
Различают:
1) альбумины (сывороточный альбумин – главный транспортный белок крови);
2) глобулины (γ-глобулин (антитела)).
Сложные белки (протеиды) содержат два компонента: белковую и небелковую часть (остатки фосфорной и нуклеиновой кислот, углеводов, липидов, атомы железа, цинка, меди), называемую простетической группой. В зависимости от характера этой группы различают:
1) нуклеопротеиды (дезоксирибонуклеопротеид - основной компонент хромосом);
2) гликопротеиды (гликофорины – белки, определяющие группу крови);
3) липопротеиды (липопротеиды низкой и высокой плотности – играют роль в обмене холестерина);
4) хромопротеиды (гемоглобин – железосодержащий пигмент крови, миоглобин – окрашивает мышцы);
5) металлопротеиды (трансфери – белок- переносчик железа);
6) фосфопротеиды (казеин молока).
Строение белковых молекул.
Молекула белка напоминает нитку, унизанную разноцветными бусинами и скрученную в виде спирали. «Бусины» - это аминокислотами. Белки разного размера включают в себя от нескольких десятков до нескольких сотен и даже тысяч аминокислот. В среднем длина белка - около 300 аминокислот. Белковые молекулы могут содержать от одного до нескольких сотен и даже тысяч аминокислотных остатков, поэтому их относительные молекулярные массы изменяются от десятков тысяч до нескольких миллионов. Так, относительная молекулярная масса гемоглобина равна 68000, яичного белка — 44000, а вируса гриппа — 32000000.
Свойства белка в первую очередь определяются порядком соединения аминокислотных остатков в полипептидной цепи.
Первичная структура белка - последовательность аминокислотных фрагментов, прочно соединенных пептидными связями. Формируется за счет COOH-группы одной аминокислоты и NH2-группы соседней аминокислоты (рис. 5).
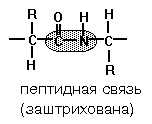
Рис. 1. Пептидная связь между молекулами аминокислот.
Хотя пептидная связь довольно прочная, ее сравнительно легко можно разрушить химическим путем – кипячением белка в крепком растворе кислоты или щелочи в течении 1-3 суток. Первичная структура закодирована в структурных генах.
Первичная структура белковой молекулы играет чрезвычайно важную роль. Изменение только одной аминокислоты на другую может привести либо к гибели всего организма, либо к появлению совершенно нового вида. Замена одного остатка аминокислоты глутамина на валин в молекуле гемоглобина (содержащего 574 аминокислотные группы!) вызывает тяжелейшее заболевание — анемию, приводящую к смертельному исходу.
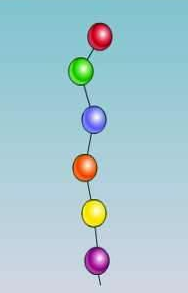
Первичная структура
В пространстве полипептидная цепь белка может быть закручена в спираль, на каждом витке которой располагается аминокислоты с обращенными наружу радикалами. Отдельные витки скреплены между собой водородными связями между группами NH и СО различных участков цепи. Такая структура белка называется ά-спираль и наблюдается, к примеру, у ά-кератина (шерсть, волосы, рога, ногти).
Таким образом, вторичная структура - это спираль, которая образуется в результате скручивания полипептидной цепи за счет водородных связей между группами СО и NH. Такая структура белка к примеру, у кератина (шерсть, волосы, рога, ногти).

Вторичная структура
Полипептидные цепочки с определенной вторичной структурой могут быть по-разному расположены в пространстве. Это пространственное расположение ά-спирали получило название третичной структуры.
Третичная структура - пространственная конфигурация спирали в пространстве. Эта структура поддерживается за счет гидрофобных взаимодействий, водородных, дисульфидных, ионных связей.
По характеру «упаковки» белковой молекулы различают глобулярные, или шаровидные, и фибриллярные, или нитевидные, белки.
Белки (по форме молекул)
Глобулярные Фибриллярные
(шаровидные) (нитевидные)
Для глобулярных белков более характерна ά-спиральная структура, спирали изогнуты, «свернуты». Макромолекула имеет сферическую форму. Они растворяются в воде и солевых растворах с образованием коллоидных систем. Большинство белков животных, растений и микроорганизмов относится к глобулярным белкам.
Для фибриллярных белков более характерна нитевидная структура. Они, как правило, не растворяются в воде. Фибриллярные белки обычно выполняют структурообразующие функции. Их свойства (прочность, способность растягиваться) зависят от способа упаковки полипептидных цепочек. Примером фибриллярных белков служат белки мускульной ткани (миозин), кератин (роговая ткань).

Третичная структура
В ряде случаев отдельные субъединицы белка с помощью водородных связей, электростатического и других взаимодействий образуют более сложные структуры.
Несколько белковых молекул могут соединяться друг с другом и образовывать четвертичную структуру.
В этом случае отдельные субъединицы белка с помощью водородных связей, электростатического и других взаимодействий образуют более сложные структуры.
Четвертичная структура - способ совместной укладки нескольких глобул. Есть не у всех белков.

Четвертичная структура
Биологическая активность белков определяется третичной и четвертичной структурами.
Физические свойства
Физические свойства белков определяются тем, к какому классу они относятся. Молекулы фибриллярных белков вытянуты в длину, нитеобразны и склонны группироваться одна возле другой с образованием волокон. Это основной строительный материал тканей: сухожилий, мускульных и покровных тканей. Такие белки в воде нерастворимы. Прочность белковых молекул просто поразительна! Человеческий волос прочнее меди и может соперничать со специальными видами стали. Пучок волос площадью 1 см2 выдерживает вес в 5 тонн, а на женской косе в 200 тыс. волосинок можно поднять груженый КамАЗ весом 20 т.
Глобулярные белки свернуты в клубочки. В организме они выполняют ряд биологических функций, требующих их подвижности и, следовательно, растворимости. Поэтому глобулярные белки растворимы в воде либо растворах солей, кислот или оснований. Из-за большого размера молекул образующиеся растворы являются коллоидными
5. Функции белков
Одна из важнейших — строительная (структурная) функция: белки участвуют в образовании всех клеточных мембран и органоидов клетки, а также внеклеточных структур. Белки, выполняющие структурные функции, занимают по количеству первое место среди других белков тела человека. Среди них важнейшую роль играет коллаген в соединительной ткани, кератин в волосах, ногтях, коже, эластин в сосудистой стенке и др. Большое значение имеют комплексы белков с углеводами в формировании ряда секретов - мукоидов, муцина и т. д. В комплексе с липидами (в частности фосфолипидами) белки участвуют в образовании биомембран клеток.
Исключительно важное значение имеет каталитическая (ферментативная) роль белков. Все ферменты — вещества белковой природы, они ускоряют химические реакции, протекающие в клетке, в десятки и сотни тысяч раз. Многочисленные биохимические реакции в живых организмах протекают в мягких условиях, при температурах, близких к 40°С, и значениях рН, близких к нейтральным. В этих условиях скорость протекания большинства реакций ничтожно мала, поэтому для их приемлемого осуществления необходимы специальные биологические катализаторы - ферменты. Как правило, ферменты - это либо белки, либо комплексы белков. Многие белки ускоряют химические реакции в сотни раз.
Двигательная функция живых организмов обеспечивается специальными сократительными белками. Эти белки участвуют во всех видах движения, к которым способны клетки и организмы: образование псевдоподий, мерцание ресничек и биение жгутиков у простейших, сокращение мышц у многоклеточных животных, движение листьев у растений и др.
В акте мышечного сокращения и расслабления участвует множество белковых веществ. Однако главную роль в этих жизненно важных процессах играют актин и миозин - специфические белки мышечной ткани. Сократительная функция присуща не только мышечным белкам, но и белкам цитоскелета, что обеспечивает тончайшие процессы жизнедеятельности клеток (расхождение хромосом в процессе митоза).
Транспортная функция белков заключается в присоединении химических элементов (например, кислорода) или биологически активных веществ (гормонов) и переносе их к различным тканям и органам тела.
Дыхательная функция крови, в частности перенос кислорода, осуществляется молекулами гемоглобина - белка эритроцитов. В транспорте липидов принимают участие альбумины сыворотки крови.
Защитная функция. При поступлении в организм чужеродных белков или микроорганизмов в белых кровяных тельцах — лейкоцитах — образуются особые белки — антитела. Они связывают и обезвреживают несвойственные организму вещества (антигены).
Высокая специфичность взаимодействия антител с антигенами (чужеродными веществами) по типу «белок - белок» способствует узнаванию и нейтрализации биологического действия антигенов. Защитная функция белков проявляется и в способности ряда белков крови к свертыванию. Свертывание белка плазмы крови фибриногена приводит к образованию сгустка крови, что предохраняет от потери крови при ранениях.
Гормональная функция. Обмен веществ в организме регулируется разнообразными механизмами. В этой регуляции важное место занимают гормоны, вырабатываемые в железах внутренней секреции. Ряд гормонов представлен белками или полипептидами, например гормоны гипофиза, поджелудочной железы и др. Инсулин – регулирует содержание сахара в крови.
Белки служат и одним из источников энергии в клетке, т. е. выполняют энергетическую функцию. При полном расщеплении 1 г белка выделяется 17,6 кДж энергии.
Свойства белков
Растворимость
По способности растворяться белки делятся на растворимые и нерастворимые. К растворимым относится белок куриного яйца. Не могут растворяться белки шерсти, перьев, ногтей.
Гидролиз
При действии воды в присутствии кислоты или ферментов белки подвергаются гидролизу. В результате расщепления белковых молекул водой образуется смесь аминокислот. Такой процесс происходит в органах пищеварения при переваривании белковой пищи. Получившиеся аминокислоты всасываются в кровь и используются организмом для синтеза собственных белков.
Денатурация
 2020-07-12
2020-07-12 151
151







