Основы термодинамики
Термодинамика изучает процессы энергообмена макроскопических тел, т.е. тел, состоящих из большого числа частиц (молекул, атомов). Состояние тел в термодинамике характеризуется макроскопическими параметрами двух типов: внешними и внутренними. Внешние параметры зависят от положения внешних тел, не входящих в исследуемую систему. Например, объём газа зависит от положения поршня; напряженности электрического и магнитного полей зависят от распределения и движения внешних зарядов и токов и т.д. Внутренние параметры определяются совокупным движением и распределением частиц, входящих в рассматриваемую систему. Например, плотность, давление, энергия, поляризованность, намагниченность и т.д.
Величины, не зависящие от предыстории системы, например, процесса перехода в данное состояние, а определяемые только её параметрами в данный момент, называются функциями состояния.
Основным энергетическим понятием термодинамики является внутренняя энергия тела U, равная сумме кинетических энергий всех частиц тела и потенциальных энергий их взаимодействия между собой, а также с внешними полями и телами. Внутренняя энергия является функцией состояния. При взаимодействии с окружающей средой происходит обмен энергией: с изменением внешних параметров и без изменения. Первая форма передачи энергии, с изменением внешних параметров, называется работой А. Например, элементарная работа расширения или сжатия газа равна

 , (1.1)
, (1.1)
где р – давление газа, Па;
dV – приращение его объема, м3.
Символ δ используется для обозначения бесконечно малого приращения величин, не являющихся функциями состояния. А работа не является функцией состояния, т.к. её величина зависит от процесса перехода системы из начального в конечное состояние. Можно определить также работу для других физических процессов. Например, для деформации твердых тел 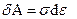 , где
, где 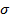 - напряжение, ε - деформация; для процесса намагничивания веществ
- напряжение, ε - деформация; для процесса намагничивания веществ 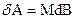 , где M- намагниченность вещества, B- индукция магнитного поля и т.д.
, где M- намагниченность вещества, B- индукция магнитного поля и т.д.
Вторая форма изменения внутренней энергии, без изменения внешних параметров, но с изменением нового внутреннего параметра - энтропии, называется теплотой, а сам процесс передачи энергии теплообменом. Элементарное количество теплоты
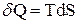 , (1.2)
, (1.2)
где Q – количество теплоты, Дж;
T – абсолютная температура, К;
S – энтропия – новый внутренний параметр, характеризующий беспорядочность теплового движения молекул или число возможных различных состояний молекул, соответствующих одному макроскопическому состоянию, Дж/К.
Теплота, как и работа, не является функцией состояния, а зависит от условий теплообмена. Согласно первому закону (началу) термодинамики: количество теплоты, сообщаемое системе, идет на изменение её внутренней энергии и совершение работы против внешних сил, т.е.
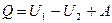
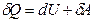 , (1.3)
, (1.3)
где первая форма закона записана для конечных, а вторая – для бесконечно малых изменений состояния системы. По своему физическому смыслу первый закон термодинамики является законом сохранения внутренней энергии.
Теплоёмкость тела как целого равна количеству теплоты, необходимому для увеличения его температуры на один Кельвин (или градус Цельсия)
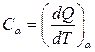 , (1.4)
, (1.4)
где под α подразумевается один или несколько параметров, при постоянстве которых происходит теплообмен, т.к. теплоёмкость существенно зависит от условий теплообмена. Наиболее часто используют изохорную теплоемкость CV – определяемую в теплообмене при постоянном объёме системы, изобарную теплоемкость Cp – при постоянном давлении.
В справочной литературе указываются удельные и молярные теплоёмкости веществ, равные количествам теплоты, необходимым для увеличения температуры на один кельвин (или градус Цельсия) единицы массы и одного моля вещества, соответственно. Аналитически удельная изохорная и изобарная теплоёмкости определяются соотношениями
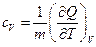 ,
, 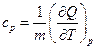 , (1.5)
, (1.5)
а соответствующие молярные теплоемкости
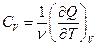 ,
, 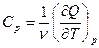 , (1.6)
, (1.6)
где m – масса вещества, кг;
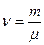 – количество вещества, моль;
– количество вещества, моль;
μ – молярная масса, кг/моль.
Поэтому удельные и молярные теплоемкости связаны соотношениями
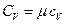 ,
, 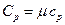 . (1.7)
. (1.7)
Т.к. в первое начало термодинамики входят три неизвестные функции Q, U, A, то для определения свойств конкретной физической системы необходимо знать два её уравнения состояния, связывающие один из внутренних параметров системы с внешними параметрами и температурой. Уравнение состояния для внутренней энергии U (m, V, p, T, …) называется калорическим, а для давления P (m, V, T, …) – термическим, В рамках термодинамики уравнения состояния могут быть получены только экспериментально.
Самой простой модельной термодинамической системой является идеальный газ. Это газ, в котором молекулы считаются материальными точками, между которыми отсутствует взаимодействие. Реальные газы хорошо описываются этой моделью при:
а) малых плотностях (или концентрациях) газа, когда можно пренебречь размерами молекул и их взаимодействием;
б) при температурах, значительно более высоких, чем температура конденсации (сжижения газа), когда кинетическая энергия молекул значительно больше потенциальной энергией их притяжения.
Уравнения состояния идеального газа получены экспериментально и имеют вид:
термическое 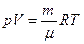 , (1.8)
, (1.8)
калорическое 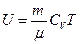 . (1.9)
. (1.9)
Первое называют также уравнением Менделеева-Клапейрона. Используя эти уравнения состояния совместно с первым законом термодинамики (1.3), можно определить все термодинамические свойства идеального газа.
В термодинамике различают следующие изопроцессы, т.е. процессы, протекающие при постоянстве одного или нескольких параметров системы:
изотермический - при 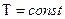 , изохорный – при
, изохорный – при  , изобарный – при
, изобарный – при  , адиабатный – при
, адиабатный – при 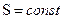 , (или
, (или 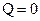 , т.е. система теплоизолирована), политропный – при
, т.е. система теплоизолирована), политропный – при 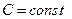 (теплоёмкость остается постоянной).
(теплоёмкость остается постоянной).
Согласно определению теплоёмкости и первому закону термодинамики в общем случае:
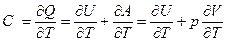 (1.10)
(1.10)
Из уравнения видно, что теплоёмкость может принимать различные значения, т.к. одному значению dT могут соответствовать различные значения δQ и δA которые существенно зависят от способа нагрева системы. Причем, для газов эта зависимость выражена значительно сильнее, чем для жидкостей и твердых тел, т.к. их объём может существенно изменяться с температурой (производная может принимать большое значение).
В изотермическом процессе (T=const), с идеальным газом из уравнения (1.8) следует уравнение Бойля-Мариотта
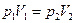 . (1.11)
. (1.11)
Из уравнения (1.9) следует, что dU=0, т.к. dT=0, поэтому изотермическая теплоемкость согласно уравнению (1.10)
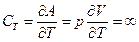 .
.
Изохорный процесс характеризуется уравнением Шарля
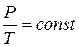 . (1.12)
. (1.12)
Работа в этом случае 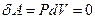 , т.к.
, т.к.  . Изохорная теплоемкость (согласно уравнениям (1.3,1.6)):
. Изохорная теплоемкость (согласно уравнениям (1.3,1.6)):
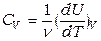 . (1.13)
. (1.13)
Изобарный процесс согласно уравнению (1.8) описывается уравнением Гей-Люсака:
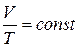 (1.14)
(1.14)
Изобарная молярная теплоемкость согласно уравнениям (1.3, 1.6, 1.8, 1.13):
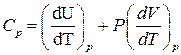 ,
,
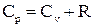 . (1.15)
. (1.15)
Последнее выражение называется соотношением Майера. Из него очевидно, что изобарная теплоемкость выше, чем изохорная. Физический смысл этого результата обсуждался в связи с соотношением (1.10) и, более конкретно, означает, что в изохорном процессе теплота идет только на увеличение внутренней энергии газа, а в изобарном процессе она идет также и на совершение работы.
В адиабатном процессе 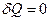 , поэтому из уравнений (1.3, 1.8, 1.9) следует
, поэтому из уравнений (1.3, 1.8, 1.9) следует
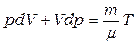 .
.
После почленного деления и преобразований получим
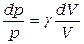 ,
,
т.е. дифференциальное уравнение с разделяющимися переменными, где введена константа
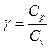 , (1.16)
, (1.16)
называемая коэффициентом Пуассона. После интегрирования получим уравнение Пуассона
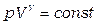 , (1.17)
, (1.17)
которое является уравнением адиабатного процесса. С помощью уравнения Менделеева-Клапейрона можно перейти в уравнении (1.17) к новым переменным.
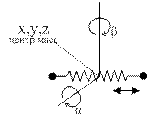
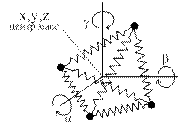
Наглядный физический смысл внутренней энергии и теплоёмкостей идеальных газов устанавливается в молекулярно-кинетической теории. Основными параметрами молекул в этой теории являются числа степеней свободы, т.е. минимальное число параметров (координат), полностью характеризующих тот или иной тип движения молекул и полное число степеней свободы, равное их сумме. Число поступательных степеней свободы i п – координаты х, у, z – характеризуют движение центра масс молекул. Вращательные степени свободы i вр характеризуют вращательное движение; колебательные степени свободы i к – колебательное движение. Возможные числа степеней свободы для одноатомных (а), двухатомных (б), трех- и многоатомных молекул (в) представлены на рис. 1.1.
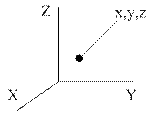
| 
| 
|
| i п= 3, (x,y,z) i вр= 0 i к= 0 | i п= 3, (x,y,z) i вр= 2, (α, β) i к= 1 | i п= 3, (x,y,z) i вр= 3, (α, β,γ) i к> 3 |
| Рисунок 1.1 – Степени свободы молекул | ||
Согласно теореме о равнораспределении энергии по степеням свободы: на каждую поступательную или вращательную степень свободы приходится одинаковая средняя кинетическая энергия
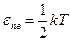 ,
,
а на каждую колебательную степень свободы приходится средняя полная механическая энергия
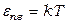 ,
,
где 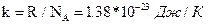 – постоянная Больцмана.
– постоянная Больцмана.
Поэтому внутренняя энергия идеального газа из N молекул без учета колебательных степеней свободы (они проявляются только при очень высоких температурах):
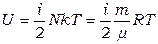 . (1.18)
. (1.18)
Как следствие из отношений (1.13, 1.15, 1.16):
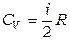 , (1.19)
, (1.19)
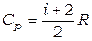 , (1.20)
, (1.20)
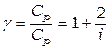 . (1.21)
. (1.21)
Таким образом, из уравнений (1.18 – 1.21) видно, что величины U, Cp, CV, γ определяются числом степеней свободы молекул. Физический смысл этого в том, что молекулы "запасают" энергию в кинетической энергии поступательного и вращательного движения.
 2020-07-12
2020-07-12 108
108








