Тема 4. Характерные химические свойства оксидов
I. Общие свойства оксидов различных классов:
Основные оксиды
1. С водой реагируют только те основные оксиды, которым соответствуют растворимые основания. Это оксиды щелочных и щелочноземельных металлов (кроме BeO и MgO), например:
K2O + H2O = 2KOH
CaO + H2O = Ca(OH)2
При этом образуются щелочи – сильные растворимые основания.
2. С кислотами основные оксиды образуют соль и воду, например:
MgO + 2HCl = MgCl2 + H2O
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Следует помнить, что с сильными и со средней силы кислотами (серной, соляной, азотной, бромоводородной, уксусной и др.) реагируют практически все основные оксиды. Со слабыми, неустойчивыми кислотами (например сернистой, угольной и др.) реагируют только оксиды щелочных и щелочноземельных металлов.
3. С кислотными оксидами основные оксиды реагируют с образованием соли, например:
NiO + SO3 = NiSO4
Na2O + CO2 = Na2CO3
При написании этих реакций нужно понимать, что образуется соль кислоты, которой соответствует данный кислотный оксид (см. раздел «Кислотные оксиды» данного пособия). Поэтому с кислотными оксидами слабых кислот (CO2, SO2 и т.п.) реагируют только оксиды щелочных и щелочноземельных металлов. Реакции с малоактивным, нерастворимым в воде кислотным оксидом SiO2 протекает только при высокой температуре (сплавлении):
Na2O + SiO2 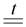 Na2SiO3
Na2SiO3
4. С амфотерными оксидами (а также с амфотерными гидроксидами) реакция протекает также только при сплавлении:
K2O + ZnO 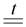 K2ZnO2
K2ZnO2
Na2O + Al(OH)3 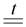 NaAlO2
NaAlO2
CaO + Al2O3 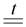 Ca(AlO2)2
Ca(AlO2)2
Кислотные оксиды
1. С водой. С водой реагируют все кислотные оксиды кроме оксида кремния SiO2, например:
N2O5 + H2O = 2HNO3
SO3 + H2O = H2SO4
Mn2O7 + H2O = H2SO4
CrO3 + H2O = H2CrO4 (избыток воды)
2CrO3 + H2O = H2Cr2O7 (недостаток воды)
2. С основными оксидами образуется соль соответствующей кислотному оксиду кислоты (см. также раздел Основные оксиды данного пособия):
CO2 + CaO = CaCO3
SiO2 + FeO 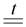 FeSiO3
FeSiO3
3. С основаниями образуется соль соответствующей кислотному оксиду кислоты и вода:
SO2 + 2NaOH = Na2SO3 + H2O
в зависимости от соотношения реагентов, могут образовываться как средние, так и кислые соли:
CO2 + KOH = КНСО3
СО2 + 2КОН = К2СО3 + Н2О
4. С амфотерными оксидами (и гидроксидами) с видимой скоростью реагируют только ангидриды сильных кислот:
SO3 + ZnO = ZnSO4
3N2O5 + 2Al(OH)3 = 2Al(NO3)3 + 3H2O
5. С солями, если образуется или более слабая, или менее растворимая, или более летучая кислота, чем та, которой соответствует реагирующий кислотный оксид, например:
более слабая:
2ClO2 + Na2CO3 = NaClO2 + NaClO3 + CO2
менее растворимая:
CO2 + K2SiO3 = K2CO3 + SiO2¯
(эта реакция протекает в растворе, можно записать, что образуется кремневая кислота:
CO2 + H2O + K2SiO3 = K2CO3 + H2SiO3¯)
более летучая кислота:
(это имеет значения при высоких температурах – сплавлении):
SiO2 + K2CO3 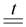 K2SiO3 + CO2
K2SiO3 + CO2
Al2O3 + 2NaHCO3 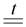 2NaAlO2 + H2O + 2CO2
2NaAlO2 + H2O + 2CO2
6. С «собственными» средними солями в растворе с образованием кислых солей:
SO2 + H2O + Na2SO3 = 2Na2SO3
CO2 + H2O + CaCO3 = Ca(HCO3)2
7. С некоторыми кислотами, например, нужно запомнить, что оксид фосфора (V) реагирует с азотной кислотой:
P2O5 + 2HNO3 = 2HPO3 + N2O5
Эта реакция возможна, так как P2O5 очень активно взаимодействует с водой, способен извлекать воду из других соединений. Кроме того, в реакции образуется газообразное вещество N2O5.
Амфотерные оксиды
Все амфотерные оксиды нерастворимые, малоактивные вещества. Они могут реагировать в обычных условиях только с высокоактивными веществами: с гидроксидами щелочных и щелочноземельных металлов, с сильными кислотами и их ангидридами. При высокой температуре возможны также реакции с менее активными оксидами (основными, кислотными и амфотерными). Рассмотрим каждый случай подробно.
1. С растворами щелочей (гидроксидов щелочных металлов, кальция, стронция и бария) амфотерные оксиды образуют комплексные соли. В кодификаторе указано, что необходимо знать комплексные соли цинка и алюминия:
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
или
Al2O3 + 6NaOH + 3H2O = 2Na3[Al(OH)6]
В этих реакциях образуются так называемые гидроксокомплексы: тетрагидроксоцинкат натрия Na2[Zn(OH)4], тетрагидроксоалюминат натрия Na[Al(OH)4] или гексагидроксоалюминат натрия Na3[Al(OH)6]. Основная сложность в составлении формул этих солей – количество групп ОН в комплексном анионе. Обычно число групп ОН это удвоенная степень окисления металла, образующего комплексный ион, но следует запомнить, что в методических рекомендациях к ЕГЭ указано, что алюминий образует комплексный ион с четырьмя группами Na[Al(OH)4]. Другие амфотерные оксиды образуют подобные комплексные соли:
BeO + 2NaOH + H2O = Na2[Be(OH)4]
Cr2O3 + 6NaOH + 3H2O = 2Na3[Cr(OH)6]
2. С сильными кислотами амфотерные оксиды реагируют как основные:
ZnO + H2SO4 = ZnSO4 + H2O
BeO + 2HCl = BeCl2 + H2O
Со слабыми кислотами и их ангидридами в обычных условиях амфотерные оксиды не реагируют.
3. При высокой температуре (при сплавлении) амфотерные оксиды могут реагировать со многими оксидами: с основными оксидами (гидроксидами) образуются соли, содержащие амфотерный металл в анионе:
Al2O3 + Na2O = 2NaAlO2
Al2O3 + 2NaOH = 2NaAlO2 + H2O
с кислотными оксидами образуются соли, содержащие амфотерный металл в катионе:
PbO + SiO2 = PbSiO3
С другими амфотерными оксидами также образуются соли:
ZnO + Fe2O3 = ZnFe2O4
II. Другие свойства оксидов (Свойства оксидов, вне зависимости от класса)
1. Окисление оксидов (взаимодействие с кислородом). С кислородом взаимодействуют оксиды, образованные элементом не в высшей степени окисления, например:
2CO + O2 = 2CO2
2SO2 + O2 = 2SO3
4FeO + O2 = 2Fe2O3
2. Восстановление оксидов. Большое значение имеет промышленное получение металлов из оксидов. В качестве восстановителей могут быть применены различные вещества: углерод, оксид углерода, газ водород, более активные металлы, аммиак.
а) Углерод – наиболее дешевый восстановитель. Его используют при выплавке металлов, которые или не образуют карбиды, или образуют неустойчивые карбиды. Восстановление углеродом используется для промышленного получения железа, меди, цинка, олова, свинка, кадмия, германия.
Металлургия железа (доменный процесс) описана в школьном учебнике. Для написания ЕГЭ надо помнить следующие реакции:
C + O2 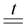 CO2
CO2
CO2 + C 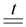 2CO
2CO
Именно оксид углерода (II) в основном восстанавливает железо в доменном процессе:
3CO + Fe2O3 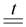 2Fe + 3CO2
2Fe + 3CO2
Железо может быть восстановлено и самим углеродом:
3C + Fe2O3 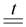 2Fe + 3CO
2Fe + 3CO
Обратим внимание, что при высокой температуре углерод переходит в CO, а не в CO2.
Процесс восстановления меди можно выразить реакциями:
CuO + CO 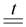 Cu + CO2
Cu + CO2
CuO + C 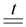 Cu + CO
Cu + CO
Некоторые элементы легко образуют карбиды, поэтому их нельзя получить в виде металла при восстановлении углеродом, например
2Al2O3 + 9C 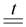 Al4C3 + 6CO
Al4C3 + 6CO
WO3 + 4C 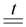 WC + 3CO
WC + 3CO
б) Водород. Некоторые малоактивные металлы (например, молибден, вольфрам) получают восстановлением водородом:
WO3 + 3H2 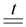 W + 3H2O
W + 3H2O
Следует помнить, что углеродом, оксидом углерода (II) и водородом можно получить из оксидов только металлы средней активности – стоящие в ряду активности после алюминия. Более активные металлы (в том числе и алюминий) в промышленности получают электролизом расплавов, а также методом металлотермии.
в) Более активные металлы. Металлотермия – способ получения менее активных металлов из их соединений восстановлением другими металлами, более химически активными. В качестве более активного металла применяют алюминий, магний, кальций, натрий. Металлотермия – основной способ получения марганца, титана, хрома:
Cr2O3 + 2Al 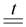 2Cr + Al2O3
2Cr + Al2O3
3. Взаимодействие с аммиаком / гидратом аммиака.
а) В водном растворе аммиака растворяются некоторые оксиды и гидроксиды d -металлов, например оксиды серебра и меди. Это возможно за счет образования комплексных соединений:
Ag2O + 4NH3·H2O = 2[Ag(NH3)2]OH + H2O
Cu(OH)2 + 4NH3·H2O = 2[Cu(NH3)4](OH)2 + 4H2O
Образуются так называемые аммиачные растворы оксида серебра и меди, широко известные реактивы в органической химии.
б) При нагревании газообразный аммиак восстанавливает оксиды малоактивных металлов:
3CuO + 2NH3 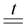 3Cu + N2 + 3H2O
3Cu + N2 + 3H2O
3PbO + 2NH3 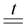 3Pb + N2 + 3H2O
3Pb + N2 + 3H2O
в) Безводный аммиак – очень слабая кислота, которая может образовывать соли (амиды) только с очень активными щелочными металлами. Реакция может протекать как с металлами, так и с оксидами и гидридами:
2Na + 2NH3 = 2NaNH2 + H2
Na2O + 2NH3 = NaNH2 + NaOH
NaH + 2NH3 = NaNH2 + H2
4. Разложение оксидов при нагревании
а) Оксиды ртути, серебра, золота и платины при нагревании теряют весь кислород и переходят в простые вещества – металлы:
2HgO 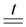 2Hg + O2
2Hg + O2
2Ag2O 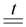 4Ag + O2
4Ag + O2
б) Оксиды металлов средней активности более устойчивы, но некоторые при нагревании до высоких температур способны частично восстанавливаться:
6Fe2O3 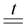 4(FeO·Fe2O3) + O2
4(FeO·Fe2O3) + O2
2(FeO·Fe2O3) 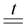 6FeO + O2
6FeO + O2
4CuO 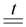 2Cu2O + O2
2Cu2O + O2
в) оксиды активных металлов устойчивы к нагреванию.
Контрольные задания по Теме 4
 2020-07-12
2020-07-12 84
84







