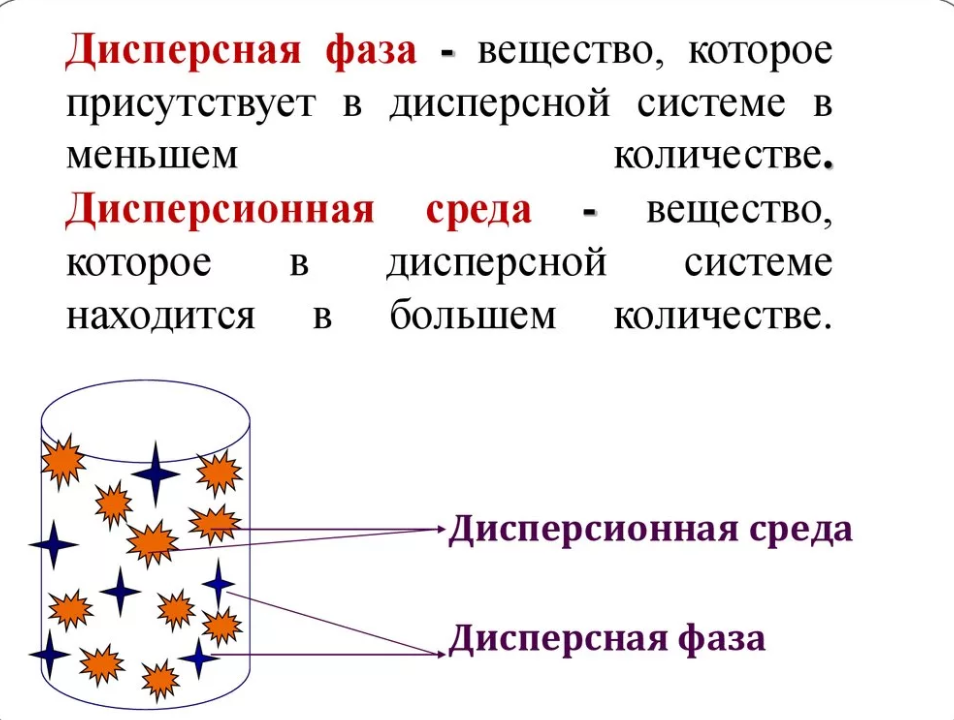
Дисперсные системы – гетерогенные системы, состоящие из дисперсионной среды (Д. с.) - растворителя, и дисперсной фазы (Д.ф.) – растворенного вещества.
Характерным свойством дисперсной системы является наличие большой межфазной поверхности, поэтому свойства поверхности для нее являются определяющими.
Классификация дисперсных систем:
По размеру частиц дисперсной фазы.
1. Микрогетерогенные (Грубодисперсные системы) >10-7м или >100 нм
2. Ультрамикрогетерогенные: коллоидные растворы (золи). ≈ 10-7 - 10-9 м, 1 - 100 нм
3. Молекулярно-ионнодисперсные: истинные растворы низкомолекулярных соединений (НМС) < 10-9 м, < 1 нм
По агрегатному состоянию дисперсной фазы и дисперсионной среды:
| Дисперсионная среда | Дисперсная фаза | Условное обозначение | Примеры дисперсных систем |
| Газ(аэрозоли) | Газ Жидкость Твердое тело | Г/Г Ж/Г Т/Г | Отсутствует Туман, облака, Дым, пыль, пыль |
| Жидкость (лиозоли) | Газ Жидкость Твердое тело | Г/Ж Ж1/Ж2 Т/Ж | Пена, Эмульсии, взвеси, суспензии |
| Твердое тело (солидозоли) | Газ Жидкость Твердое тело | Г/Т Ж/Т Т1/Т2 | Пемза, хлеб, почва, грунт, минералы,сплавы |
По степени взаимодействия дисперсной фазы с дисперсионной средой:
Лиофобные системы: коллоидные растворы, суспензии, эмульсии, пены, аэрозоли.
· Слабое взаимодействие между д.ф. и д.с
· Образуются за счет энергии извне
· Термодинамически неустойчивы
· Для устойчивости необходим стабилизатор
Лиофильные системы: растворы коллоидных ПАВ и высокомолекулярных соединений (ВМС)
· Сильное взаимодействие между д.ф. и д.с.
· Образуются самопроизвольно
· Термодинамически устойчивы
· Устойчивы без стабилизатора
По наличию взаимодействия между частицами дисперсной фазы:
Свободнодисперсные системы: лиозоли, суспензии, эмульсии, аэрозоли.
(Частицы дисперсной фазы не связаны между собой и могут свободно перемещаться в объеме дисперсионной среды.)
Связнодисперсные системы: студни, пористые капиллярные системы
(Частицы дисперсной фазы имеют между собой устойчивые связи, образуя сплошную структуру (сетку каркас), внутри которой заключена дисперсионная среда)
Дисперсное состояние веществ.
Вещество в дисперсном состоянии стремится поглотить другие вещества. Растворимость газов в каплях выше, чем в жидкости большого объема.
Например, из-за того, что растворимость кислорода в капле воды высока, коррозия железа происходит даже без примесей в железе других веществ. Под каплей воды на поверхности железа коррозия проявляется в первую очередь у краев капли, где растворимость кислорода больше.
Получение и стабилизация дисперсных систем.
Два метода получения дисперсных систем – диспергирование и конденсация
Диспергирование и конденсация – методы получения свободнодисперсных систем: порошков, суспензий, золей, эмульсий и т. Д. Под диспергированием понимают дробление и измельчение вещества, под конденсацией – образование гетерогенной дисперсной системы из гомогенной в результате ассоциации молекул, атомов или ионов в агрегаты. Конденсация происходит при образовании тумана, при кристаллизации.
Стабилизацию лиофобных дисперсных систем проводят с целью повышения агрегативной устойчивости, т.е. для предотвращения коагуляции. В качестве стабилизаторов широко применяют поверхностно–активные вещества (ПАВ) и высокомолекулярные соединения (ВМС).
Стабилизатор- это вещество, добавление которого в дисперсную систему повышает его агрегативную устойчивость, т.е. препятствует слипанию частиц.
Строение дисперсной фазы и дисперсионной среды:
Поверхностные явления на границе сред. Поверхностное натяжение. Особенности поверхностного слоя на границе раздела фаз. Физический смысл. Размерность. Зависимость от температуры, давления, химического состава, полярности вещества. Экспериментальные методы измерения величины межфазного поверхностного натяжения. Смачивание.
Поверхностные явления – совокупность явлений, обусловленные физико-химическими свойствами на границе между соприкасающимися веществами.
Т.е это те явления, которые происходят на поверхности, обусловленные поверхностной энергией.
Удельная поверхность: Sуд = S/V
К поверхностным явлениям относятся:
1) поверхностное напряжение (см. дальше)
2) капиллярные явления (поверхностные явления на границе жидкости с другой средой, связанные с искривлением ее поверхности)
Функция Лапласа (формула для капиллярного давления) P = σ(dS/dV)
3) адгезия (характеризует прилипание вещества одной фазы к другой фазе) и когезия (сцепление частей одного и того же однородного тела (жидкого или твердого))
4) трения
5) адсорбционные и десорбционные явления
Уравнение адсорбции Гиббса: Γ = -(∂σ/∂μ)*(C/RT)
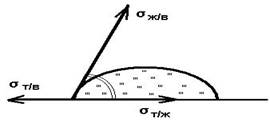
6) смачивание (поверхностное явление, наблюдаемое при контакте жидкости с твердым телом в присутствии третьей фазы-газа (пара) или другой жидкости, которая не смешивается с первой. Характерная особенность смачивания - наличие линий контакта трех фаз (линии смачивания).
Основные термодинамические характеристики смачивания - равновесный краевой угол смачивания q0, работа адгезии Wa, теплота смачивания qW. Равновесный краевой угол смачивания определяется наклоном поверхности жидкости (напр., капли) к смоченной ею поверхности твердого тела; вершина угла находится на линии смачивания. Равновесный краевой угол определяется уравнением Юнга:
cosq0= (ss-ssl)/ssl,
где ss и ssl-соотв. удельной поверхностные энергии твердого тела на границе с газом и в контакте со смачивающей жидкостью, sl-поверхностное натяжение жидкости.
Поверхностное натяжение: σ = (dG/dS)T,p,ni
Т.е поверхностное натяжение — термодинамическая характеристика поверхности раздела двух находящихся в равновесии фаз, определяемая работой обратимого изотермокинетического образования единицы площади этой поверхности раздела при условии, что температура, объём системы и химические потенциалы всех компонентов в обеих фазах остаются постоянными.
Стремление поверхностной энергии к минимуму вызывает искривление поверхности жидкости. Поэтому можно предположить наличие связи между поверхностной энергией и формой.
Термодинамика поверхности:
Поверхностная энергия – энергия, сосредоточенная на границе раздела фаз, избыточная по сравнению с энергией в объёме. Кристаллические вещества характеризуются анизотропией поверхностной энергии: наименьшей поверхностной энергией обладают грани с наибольшей плотностью частиц.
 2020-07-12
2020-07-12 594
594








