Опыты подтвердили правильность ядерной модели атома Резерфорда, поэтому ученым пришлось признать ограниченность применения законов классической физики.
Первым решился на это признание выдающийся физик XX в. датский ученый Нильс Бор. В 1913 г. он, основываясь на разрозненных экспериментальных фактах, с помощью гениальной интуиции сформулировал в виде постулатов основные положения новой теории.
Изучая противоречия модели атома Резерфорда законам классисической физики Нильс Бор в 1913 г. выдвигает "постулаты", определяющие строение атома и условия испускания и поглощения им электромагнитного излучения.
Постулаты Бора показали, что атомы "живут" по законам микромира.
I постулат - постулат стационарных состояний:
В атоме существуют стационарные квантовые состояния, не изменяющиеся с течением времени без внешнего воздействия на атом.
В этих состояниях атом не излучает электромагнитных волн, хотя и движется с ускорением.
Каждому стационарному состоянию атома соответствует определенная энергия атома.
Стационарным состояниям соответствуют стационарные орбиты, по которым движутся электроны.
II постулат - правило частот:
При переходе атома из одного стационарного состояния в другое излучается или поглощается 1 фотон.
а) Атом излучает 1 фотон(который несет 1 квант энергии), когда электрон переходит из состояния с большей энергией (Е k) в состояние с меньшей энергией (Е n).
Энергия излученного фотона:
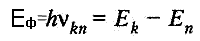
Здесь (Ek - En) - разность энергий стационарных состояний.
При Ек > Eп происходит излучение фотона.
Частота излучения:
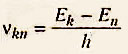
где k и n - номера стационарных состоянии, или главные квантовые числа.
б) Атом поглощает 1 фотон, когда переходит из стационарного состояния с меньшей энергией (E n) в стационарное состояние с большей энергией (E k).
При Ек < Еn происходит поглощение фотона.
После экспериментальных проверок правильности модели атома Резерфорда и принятия постулатов Бора ученым пришлось признать ограниченность применения законов классической физики для микроскопических тел.
Модель атома водорода по Бору
Свои постулаты Н. Бор применил для построения теории строения простейшего атома (атома водорода).
Согласно этой теории Бор смог вычислить для атома водорода:
- возможные радиусы орбит электрона и размеры атома
- энергии стационарных состояний атома
- частоты излучаемых и поглощаемых электромагнитных волн.
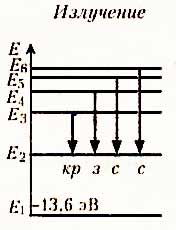
Распределение энергетических уровней при излучении (испускании) и поглощении атомом водорода электромагнитных волн:
 ....
.... 
При (n = 1) - основное энергетическое состояние, ему соответствует радиус орбиты электрона r = 0,5 • 10 -11 м.
При (n больше 1) - возбужденные состояния.
При поглощении атомом кванта энергии (фотона) атом переходит в возбужденное состояние, при этом электрон переходит на более отдаленную орбиту и его связь с ядром слабеет.
Переходы в первое возбужденное состояние (Е2) с верхних уровней соответствует частотам видимой части (кр з с с) спектра водорода.
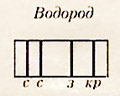
Линечатый спектр атома водорода состоит из линий, сгруппированных в серии.
Частоты каждой серии спектра можно подсчитать по формуле Бальмера-Ритберга:
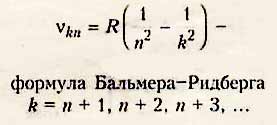
В спектре водорода обнаружены следующие серии:
n = I - серия Лаймана - ультрафиолетовое излучение
n = 2 - серия Бальмера - видимое излучение
n = 3 - серия Пашена - инфракрасное излучение и т.д.
Однако, надо помнить, что для атомов с большим числом электронов (больше 1) расчеты по теории Бора неприменимы.
P.S. Надо помнить!
Движение электрона в атоме мало похоже на движение планет по орбитам.
Точнее, электрон на орбите можно назвать электронным облаком, имеющим разную плотность.
Орбитой электрона в атоме называется геометрическое место точек, в которых с наибольшей вероятностью можно обнаружить электрон.
Энергия в атомной физике измеряется в электронвольтах.
1эВ – это энергия электрона, проходящего разность потенциалов в 1В.
Лекции по физике
 2020-08-05
2020-08-05 159
159








