Лабораторная работа № 1
Тема. Алюминий и его соединения.
Цель: познакомить с некоторыми химическими свойствами металлического алюминия, гидроксида и солей алюминия.
Реактивы: металлический алюминий Al, раствор хлорида алюминия AlCl3, раствор карбоната натрия Na2CO3, раствор хлорида кобальта (II) CoCl2, раствор соляной кислоты HCl (разбавленный), раствор серной кислоты H2SO4 (концентрированный и разбавленный), раствор ортофосфорной кислоты H3PO4, раствор азотной кислоты HNO3 (разбавленный), раствор гидроксида натрия NaOH (ω = 30%).
Посуда и оборудование: спиртовка, держатель для пробирок, штатив для пробирок, пинцет, пробирки.
Ход работы:
Опыт 1. Свойства металлического алюминия
| Этап работы | Порядок выполнения | Рисунок и объяснения к нему | Уравнение реакции | Выводы |
| Опыт 1. Свойства металлического алюминия 1.Взаимодействие алюминия с кислотами. | 1.В три пробирки поместили по одной грануле алюминия: а).в первую пробирку прилили несколько капель разбавленной соляной кислоты; б).во вторую пробирку прилили несколько капель разбавленной азотной кислоты; в).в третью пробирку прилили несколько капель разбавленной ортофосфорной кислоты; | 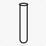 Алюминий растворяется разбавленной соляной кислоте, при этом выделя-ется бесцветный газ
(проведение опыта отобразить в виде рисунка)
Алюминий растворяется разбавленной соляной кислоте, при этом выделя-ется бесцветный газ
(проведение опыта отобразить в виде рисунка)
| 2Al + 6HCl = 2AlCl3 + 3H2
Al0 – 3e  Al3+восстановитель
2H+ + 2e Al3+восстановитель
2H+ + 2e  H2 окислитель H2 окислитель
| Алюминий заимодействует с соляной кислотой, проявляя восстановительные свойства, в результате реакции образуется соль – хлорид алюминия и выделяется бесцветный газ - водород |
| 2.Взаимодействие алюминия с разбавленной и концентрированной серной кислотой | ||||
| 3.Взаимодействие алюминия с солями | ||||
| Этап работы | Порядок выполнения | Рисунок и объяснения к нему | Уравнение реакции | Выводы |
| Опыт №2. Взаимодействие алюминия со щелочью | Поместили гранулу алюминия в пробирку и прилили несколько капель раствора гидроксида натрия. | Алюминий растворяется в растворе щелочи, при этом выделяется бесцветный газ | 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Al0 + 4OH-– 3e  [Al(OH)4]-
восстановитель
2H+ + 2e [Al(OH)4]-
восстановитель
2H+ + 2e  H2
окислитель H2
окислитель
| Алюминий взаимодействует с раствором гидроксида натрия, проявляя восстановительные свойства, в результате реакции образуется комплексная соль – тетрагидроксо-алюминат натрия и выделяется бесцветный газ – водород. Металлический алюминий реагирует с растворами кислот и щелочей, он проявляет амфотерные свойства. |
* Аналогично описываются все остальные опыты
* Опыт№3. Химические свойства оксида алюминия
* Опыт№4. Химические свойства гидроксида алюминия.
* Опыт №5.Химические свойства солей алюминия.
 Оксид и гидроксид алюминия обладают амфотерными свойствами. Вступают в реакцию с кислотами и основаниями (щелочами).
Оксид и гидроксид алюминия обладают амфотерными свойствами. Вступают в реакцию с кислотами и основаниями (щелочами).
 2020-08-05
2020-08-05 439
439






