Твёрдые тела - вещества, длительное время сохраняющие свою форму и объём
В твердых кристаллических телах молекулы образуют упорядоченные структуры во всем объеме кристалла и могут совершать тепловые колебания около фиксированных центров. Молекулы в кристаллах привязаны к определенным центрам и не могут перемещаться по всему объему тела. Этим объясняется то, что твердые тела сохраняют свою форму и объем.
По своим физическим свойствам и молекулярной структуре твердые тела разделяются на два класса – аморфные и кристаллические тела.
Молекулы и атомы в аморфных телах располагаются хаотично, образуя лишь небольшие локальные группы, содержащие несколько частиц (ближний порядок). По своей структуре аморфные тела очень близки к жидкостям. Для аморфных тел, как и для жидкостей, характерен ближний порядок в расположении частиц, но, в отличие от жидкостей, подвижность частиц мала.
Их свойства (механические, тепловые, электрические, оптические) по всем направлениям одинаковы, т.е. аморфные тела изотропны. Изотропность - независимость всех физических свойств (механических, оптических и т. д.) от направления.
Примерами аморфных тел могут служить стекло, различные затвердевшие смолы (янтарь), воск, смола, пластики и т. д. Аморфные тела являются переохлажденными жидкостями (жидкости с большой вязкостью).
Характерной особенностью аморфных тел является отсутствие у них определенной точки плавления, т.е. нельзя указать температуру, выше которой будет жидкое состояние, а ниже – твердое. Если аморфное тело нагревать, то оно постепенно размягчается, и переход в жидкое состояние занимает значительный интервал температур. Со временем в аморфных телах происходит кристаллизация, поэтому стекло с течением времени теряет прозрачность, мутнеет. В последнее время очень широкое практическое применение получили органические аморфные тела – полимеры. Молекулы полимеров состоят из большого числа одинаковых длинных молекулярных цепочек, соединенных химическими связями. К полимерам относятся крахмал, белок, каучук, пластмасса, резина, капрон и др. вещества. Полимеры обладают прочностью и эластичностью, некоторые из них могут выдерживать растяжение, превышающее их первоначальную длину в 5–10 раз.
В кристаллических телах частицы располагаются в строгом порядке, образуя пространственные периодически повторяющиеся структуры во всем объеме тела. Для наглядного представления таких структур используются пространственные кристаллические решетки, в узлах которых располагаются центры атомов или молекул данного вещества.
Частицы в кристаллах образуют пространственные периодически повторяющиеся структуры, которые называют кристаллические решетки.
Точки в кристаллической решетке, соответствующие наиболее устойчивому положению равновесия частиц твердого тела, называются узлами решетки.
Правильное расположение частиц в узлах кристаллической решетки называют дальним порядком.
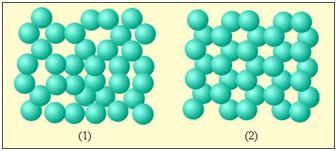
Пример ближнего порядка молекул аморфного тела и дальнего порядка молекул кристаллического вещества:
1 – аморфное тело; 2 – твердое тело.
Правильное расположение частиц в решетке является причиной анизотропии кристаллов.
Анизотропия кристаллов заключается в зависимости некоторых физических свойств кристаллов от направления (скорость распространения света, теплопроводность, модуль упругости).
Кристаллические тела могут быть монокристаллами и поликристаллами.
Крупные одиночные кристаллы называют монокристаллами.
Поликристаллы состоят из многих сросшихся между собой хаотически ориентированных маленьких кристалликов, которые называются кристаллитами.
Большие монокристаллы редко встречаются в природе и технике. Чаще всего кристаллические твердые тела, в том числе и те, которые получаются искусственно, являются поликристаллами.
Монокристаллы анизотропны. В отличие от монокристаллов, поликристаллические тела изотропны, то есть их свойства одинаковы во всех направлениях. Поликристаллическое строение твердого тела можно обнаружить с помощью микроскопа, а иногда оно видно и невооруженным глазом (чугун).
Многие вещества могут существовать в нескольких кристаллических модификациях (фазах), отличающихся физическими свойствами. Это явление называется полиморфизмом.
Переход из одной модификации в другую называется полиморфным переходом.
Интересным и важным примером полиморфного перехода является превращение графита в алмаз. Этот переход при производстве искусственных алмазов осуществляется при давлениях 60–100 тысяч атмосфер и температурах 1500–2000 К.
В зависимости от характера сил взаимодействия и природы частиц, находящихся в узлах кристаллической решетки, различают четыре типа кристаллических решеток.
1. Ионные кристаллы. В узлах кристаллической решетки находятся ионы (положительно и отрицательно заряженные) атомов, которые входят в состав молекулы данного вещества. Связь между ними обусловлена электрическими (кулоновскими) силами взаимодействия (притяжения) между разноименными ионами.
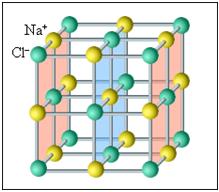
Примером ионной решетки служит кристалл каменной соли NaCl. Кристаллическая решетка поваренной соли содержит ионы Na+ и Cl–, не объединенные попарно в молекулы NaCl. (следует помнить, что частицы в кристаллах плотно упакованы, так что расстояние между их центрами приблизительно равно размеру частиц. В изображении кристаллических решеток указывается только положение центров частиц)
2. Атомные кристаллы. В узлах кристаллической решетки находятся нейтральные атомы. Между ними существует ковалентная связь (связь, при которой каждые два соседних атома удерживаются рядом силами притяжения, возникающими при взаимном обмене между этими атомами двумя валентными электронами).
Примером атомных кристаллов являются алмаз, графит, германий, кремний.
3. Молекулярные кристаллы. В узлах кристаллической решетки находятся молекулы, ориентированные определенным образом. Между молекулами действуют силы притяжения, характерные для взаимодействия молекул.
К молекулярным кристаллам относятся нафталин, парафин, сухой лед СО2, лед Н2О.
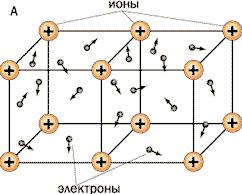
4. Металлические кристаллы. В узлах кристаллической решетки находятся положительные ионы металла, между которыми движутся свободные (валентные) электроны, образующие электронный газ. Связь в металлических кристаллах обеспечивается силами притяжения между положительными ионами, находящимися в узлах решетки, и отрицательным электронным газом.
Эти силы притяжения уравновешиваются силами отталкивания между одноименными ионами.
По геометрической конфигурации кристаллические решетки можно разделить на кубические и гексагональные.
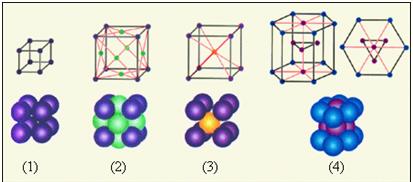
Простые кристаллические решетки:
1 – простая кубическая решетка;
2 – гранецентрированная кубическая решетка;
3 – объемноцентрированная кубическая решетка;
4 – гексагональная решетка.
В простой кубической решетке частицы располагаются в вершинах куба. В гранецентрированной решетке частицы располагаются не только в вершинах куба, но и в центрах каждой его грани. Изображенная на рис. 4 решетка поваренной соли состоит из двух вложенных друг в друга гранецентрированных решеток, состоящих из Na+ и Cl–.
В объемноцентрированной кубической решетке дополнительная частица располагается в центре каждой элементарной кубической ячейки.
В настоящее время большой интерес вызывает новый класс веществ – жидкие кристаллы.
Это почти прозрачные вещества, проявляющие одновременно свойства жидкости и кристалла. Жидкие кристаллы открыл в 1888 г. австрийский ботаник Ф. РЕЙНИТЦЕР. Он обратил внимание, что у кристаллов холестерилбензоата и холестерилацетата было две точки плавления и, соответственно, два разных жидких состояния — мутное (от 145 °С до 179 °С) и прозрачное (выше 179 °С).
Жидкие кристаллы находят широкое практическое применение. Многие вещества в жидкокристаллическом состоянии обладают весьма ценным качеством: некоторые их свойства резко изменяются при незначительном изменении внешних условий (температура, длина волны облучаемого света, электрическое и магнитное поля и т. д.). Оптическую ось в жидких кристаллах можно легко ориентировать электрическим полем. Этот эффект используется при построении жидкокристаллических индикаторов и экранов. На основе жидких кристаллов разработан преобразователь инфракрасного изображения в видимое, применяемый в медицине, военном деле и других отраслях. Некоторые жидкие кристаллы весьма чувствительны к присутствию паров различных химических веществ: при наличии в воздухе ничтожно малой концентрации этих веществ структура жидкого кристалла меняется, что сопровождается изменением его цвета.
Молекулы жидких кристаллов не образуют кристаллической решетки, но ввиду своей формы (плоские, нитевидные) могут выстраиваться при незначительном воздействии в определенном порядке. Структура при этом приобретает свойства слоистых или нитевидных кристаллов. Упорядоченное расположение молекул в жидких кристаллах наблюдается лишь по одному направлению. Структура, соответствующая жидким кристаллам, возникает в органических веществах, молекулы которых имеют нитевидную вытянутую форму или же форму плоских пластин. Например, растворенное в воде мыло образует жидкие кристаллы. Молекула мыла имеет форму палочки. Тот конец молекулы, который имеет отрицательный заряд, тяготеет к молекулам воды, это является причиной упорядоченной ориентации молекул мыла по отношению к воде. Мыльный раствор (в воде) состоит из большого числа двойных слоев молекул мыла, разделенных слоем воды. Двойные слои, образующие жидкий кристалл, обладают большой подвижностью, что определяет моющие свойства мыла. Частички грязи и очищаемая поверхность покрываются слоями жидких кристаллов, легко скользящих один относительно другого. При небольшом механическом воздействии частички грязи, обволакиваемые «шубой» жидких кристаллов легко переходят в раствор и уносятся вместе с водой.
Жидкие кристаллы обнаруживаются в важнейших функциональных участках клетки живых организмов. Распространенность жидкокристаллического состояния в живых тканях обусловлена его высокой чувствительностью к окружающей среде, гибкостью структуры и достаточной устойчивостью к внешним воздействиям. Для обмена веществ с окружающей средой (основная особенность живой клетки) жидкие кристаллы являются идеальными образованиями, так как они могут растворять многие вещества, не изменяя своей жидкокристаллической структуры, легко обмениваться молекулами. При соответствующих условиях жидкие кристаллы могут набухать, а затем опять сжиматься, не теряя жидкокристаллического строения, в мышечных волокнах они могут растягиваться и сжиматься, не разрушаясь. Значительная прочность жидкокристаллических волокон необходима для образования опорных тканей.
Механические свойства твердых тел.
В твердых телах – аморфных и кристаллических – частицы (молекулы, атомы, ионы) совершают тепловые колебания около положений равновесия, в которых энергия их взаимодействия минимальна. При увеличении расстояния между частицами возникают силы притяжения, а при уменьшении – силы отталкивания. Силы взаимодействия между частицами обусловливают механические свойства твердых тел.
Деформация твердого тела является результатом изменения под действием внешних сил взаимного расположения частиц, из которых состоит тело, и расстояний между ними.
Деформация – изменение формы или объема тела.
Существует четыре основных вида деформаций твердых тел: растяжение (сжатие), сдвиг, кручение, изгиб.
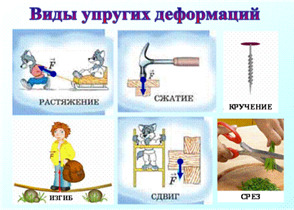
При любом виде деформации в твердом теле происходит смещение частиц, из которых оно состоит, относительно друг друга. Это вызывает возникновение в материале сил, препятствующих деформации – сил упругости. Они стремятся восстановить прежнюю форму и объем тела.
Свойство деформированных тел принимать свою первоначальную форму и свой объем после прекращения действия внешних сил называется упругостью.
Упругая деформация – деформация, которая полностью исчезает после снятия внешних нагрузок (деформирующих факторов).
Пластическая деформация – деформация тела, которая не исчезает после снятия внешних нагрузок на тело.
Простейшим видом деформации является деформация растяжения или сжатия.
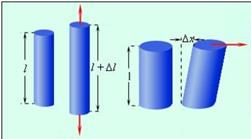
1 – деформация растяжения; 2 – деформация сдвига
Ее можно характеризовать абсолютным удлинением Δl, возникающим под действием внешней силы F. Связь между Δ l и F зависит не только от механических свойств вещества, но и от геометрических размеров тела (его толщины и длины).
Отношение абсолютного удлинения Δ l к первоначальной длине l образца называется относительным удлинением или относительной деформацией ε:
ε = Δl/ l
При растяжении ε > 0, при сжатии ε < 0.
Если принять направление внешней силы, стремящейся удлинить образец, за положительное, то F > 0 при деформации растяжения и F < 0 – при сжатии.
Отношение модуля внешней силы F к площади S сечения тела называется механическим напряжением σ:
σ = F/S
За единицу механического напряжения в СИ принят паскаль (Па). Механическое напряжение измеряется в единицах давления. Оно характеризует действие внутренних сил в деформированном твердом теле.
Связь между упругими деформациями и внутренними силами в материале впервые была установлена английским ученым Р. Гуком.
Закон Гука: механическое напряжение в упруго деформированном теле прямо пропорционально относительной деформации этого тела.
σ = k* ε
k – коэффициент упругости (модуль упругости), характеризующий упругие свойства материала – зависимость механического напряжения от рода материала и от внешних условий.
Другая форма записи закона Гука: ε = σ/Е
Коэффициент E в этом соотношении называется модулем Юнга – величина, обратная коэффициенту упругости. Е = 1/k
Зависимость между ε и σ является одной из важнейших характеристик механических свойств твердых тел. Графическое изображение зависимости между ε и σ называется диаграммой растяжения.
По оси абсцисс откладывается относительное удлинение ε, а по оси ординат – механическое напряжение σ.
Типичный пример диаграммы растяжения для металлов (таких как медь или мягкое железо) представлен на рисунке:
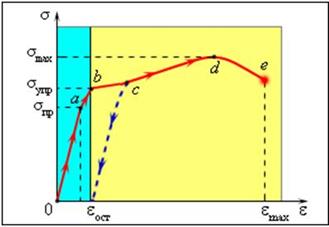
Типичная диаграмма растяжения для пластичного материала.
Голубая полоса – область упругих деформаций.
Участок OA на диаграмме – упругая деформация.
При малых деформациях (обычно существенно меньших 1 %) связь между σ и ε линейная. Максимальное значение σ = σпр, при котором сохраняется линейная связь между σ и ε, называется пределом пропорциональности (точка A).
На линейном участке выполняется закон Гука: ε = σ/Е
Участок AB - еще упругая деформация. При дальнейшем увеличении напряжения связь между σ и ε становится нелинейной, однако при снятии напряжения деформация практически полностью исчезает, то есть восстанавливаются размеры тела. Максимальное напряжение на этом участке σупр называется пределом упругости.
Если σ > σупр, образец после снятия напряжения уже не восстанавливает свои первоначальные размеры и у тела сохраняется остаточная деформация εост.
Участки BC, CD и DE – пластическая деформация.
На участке BC деформация происходит почти без увеличения напряжения. Это явление называется текучестью материала.
В точке D достигается наибольшее напряжение σmax, которое способен выдержать материал без разрушения - предел прочности.
В точке E происходит разрушение материала.
Для расчета различных конструкция необходимо знать механические свойства твердых тел.
Прочность – способность материала выдерживать нагрузки без разрушения.
У многих материалов предел прочности значительно больше предела упругости. Такие материалы называют вязкими. К ним относятся медь, цинк, железо.
Материалы, у которых отсутствует область упругих деформаций, называют пластическими. К ним относят воск, глину, пластилин.
В технике материалы различают по твердости. Из двух материалов более твердым считается тот, который оставляет царапины на поверхности другого. Из природных материалов наибольшей твердостью отличается алмаз.
Материалы, у которых разрушение происходит при небольших деформациях (лишь незначительно превышающих область упругих деформаций) называются хрупкими (стекло, фарфор, чугун).
 2020-08-05
2020-08-05 2812
2812
