1. Строение ядра. Как определять числа протонов, нейтронов в ядре.
2. Как определять число валентных электронов для элементов главных подгрупп.
3. Как определить число электронов для элементов побочных подгрупп. Понятие «проскока электрона».
4. Составление схем, электронных и электронно-графических формул.
5. Возбужденное состояние
6. Частицы. Чем отличаются от атома, как составлять для них формулы.
1. Число протонов и электронов в атоме равно порядковому номеру элемента. Число нейтронов – разнице между массовым числом и порядковым номером элемента.
2. Внешние электроны = валентные электроны!!!
Число валентных электронов для элементов главных подгрупп равно номеру группы (по вертикали).
Хлор находится в 7 группе – на внешнем уровне 7 валентных электронов. Число уровней определяется по номеру периода, где стоит элемент (по горизонтали).
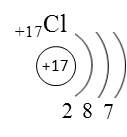
Число электронов необходимых для завершения уровня для элементов главных подгрупп равно 8 - № группы элемента.
Т.к. хлор стоит в 7 группе, то для завершения уровня ему не хватает 8 – 7 = 1 электрона.
3. Для элементов побочных подгрупп число валентных электронов на внешнем уровне равно, как правило, 2 (кроме меди, молибдена, серебра, золота, платины – у них 1!!! из-за «проскока электрона»). Однако максимально у этих элементов на внешнем уровне может содержаться число электронов, равных номеру группы элемента.
4. Каждый энергетический уровень содержит определенное число подуровней (орбиталей) (как на этаже в доме находится несколько квартир).
· 1-ый уровень содержит только s – орбиталь.
· 2-ой уровень содержит s и p – орбитали.
· На 3-ем уровне к s и p – орбиталям добавляется d – орбиталь.
Каждая орбиталь содержит определенное число электронов (меньше может быть, больше – нет!!!):
· s максимально содержит 2 электрона
· p максимально содержит 6 электронов
· d максимально содержит 10 электронов
Примеры электронно-графических формул атомов углерода в основном и возбужденном состояниях.

Примеры электронно-графических формул атомов углерода (возбужденное состояние) и азота (основное состояние)
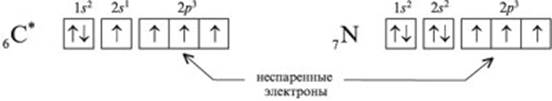
5. В результате возбуждения атома за счет поглощения энергии происходит распаривание электронов внешнего уровня и их переход в свободные ячейки этой же или другой орбитали этого уровня! (Не у всех элементов есть свободные ячейки на данном уровне; например, у азота таковых нет, поэтому возбуждаться данный атом не может).
6. Атом – электронейтральная структура, т.е. его суммарный заряд равен 0. У частицы же в отличии от атома есть заряд (если «+», то это катион, если «–», то это анион). Атом превращается в частицу, если он отдает внешние электроны (суммарное число электронов понижается и атом превращается в положительный катион; сколько электронов отдал, такой минусовой заряд и будет) или если он принимает электроны на внешний уровень (суммарное число электронов повышается и атом превращается в отрицательный анион; сколько электронов принял, такой плюсовой заряд и будет).
Пример: электронное строение атома натрия описывается формулой 1s22s22p63s1. В результате возбуждения атом отдает другому атому один электрон с внешнего уровня и превращается в частицу Na+, электронное строение которой совпадает с электронным строением атома неона Ne0 (1s22s22p6).
 2020-08-05
2020-08-05 406
406






