ЭКЗАМЕНАЦИОННЫЕ ЗАДАЧИ
ПО АНАЛИТИЧЕСКОЙ ХИМИИ
основная профессиональная образовательная программа высшего образования
программа специалитета 33.05.01 ФАРМАЦИЯ
Предел обнаружения ионов
1. Рассчитайте предел обнаружения ионов свинца в виде свинца иодида при условии, что реакция удается с 0,02 мл 0,003 моль/л раствора свинца нитрата.
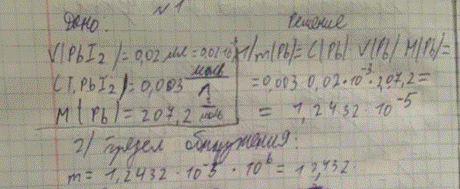 |
Титр
81. Вычислите титр (мг/мл) соляной кислоты (М = 36,461), если на титрование навески калия карбоната (М = 138,206) массой 0,1935 г было затрачено 15,00 мл титранта с индикатором метиловым оранжевым.

73. Навеску калия хлорида (М = 74,551) массой 0,03000г оттитровали 13,12млраствора серебра нитрата (М = 169,873). Вычислите титр раствора титранта.
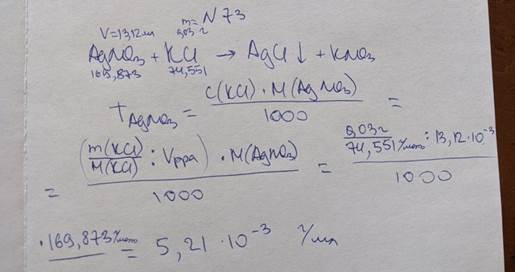
74. Навеску калия хлорида (М = 74,551) массой 0,03500 г оттитровали 15,10 мл раствора серебра нитрата (М = 169,873). Вычислите титр раствора титранта.
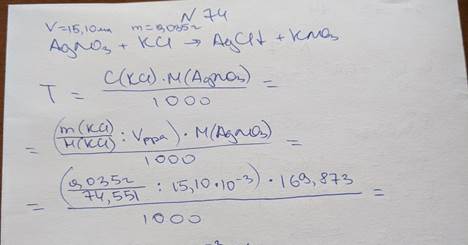
85. Навеску калия хлорида (М = 74,551) массой 0,03000г оттитровали 13,12млраствора серебра нитрата (М = 169,873). Вычислите титр раствора титранта.
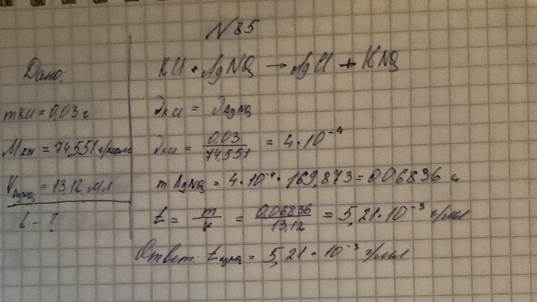
86. Навеску калия хлорида (М = 74,551) массой 0,02500 г оттитровали 13,00 мл раствора серебра нитрата (М = 169,873). Вычислите титр раствора титранта.
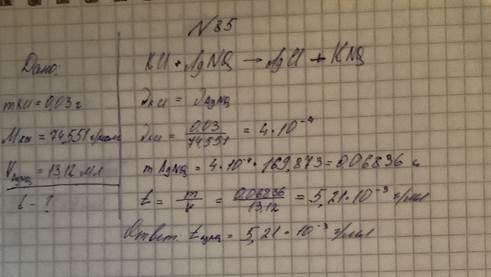
Активность ионов
14. Рассчитайте активность сульфат-ионов в растворе, полученном при смешивании равных объемов 0,05 моль/л раствора аммиака и 0,4 моль/л раствора аммония сульфата.
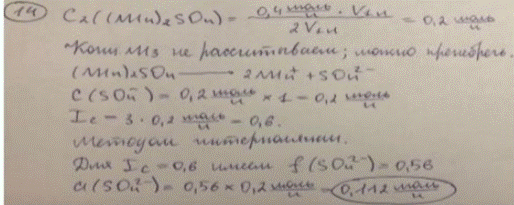
16. Смешали равные объемы растворов алюминия ацетата и уксусной кислоты с молярной концентрацией каждого по 0,20 моль/л. Рассчитайте активность ионов алюминия в полученном растворе.

17. Рассчитайте активность ионов аммония в растворе, полученном при смешивании равных объемов 0,4 моль/л раствора аммиака и 0,6 моль/л раствора аммония карбоната.
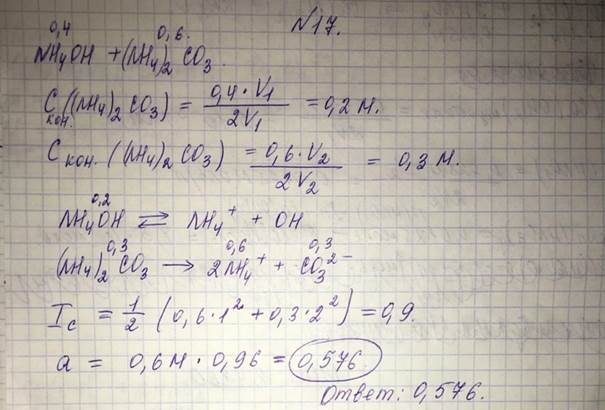
18. Рассчитайте активность ацетат-ионов в растворе, полученном при смешивании равных объемов 0,2 моль/л раствора цинка ацетата и 0,3 моль/л раствора уксусной кислоты.
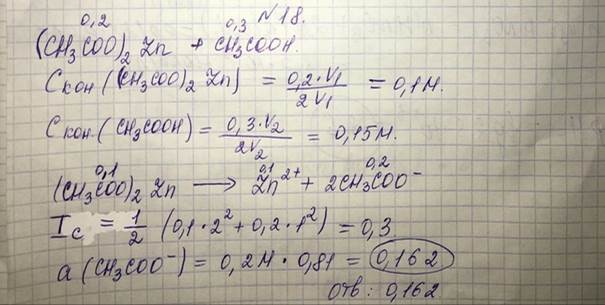
8. Сколько граммов кальция оксалата может раствориться в 200 мл 0,001 моль/л раствора оксалата натрия? Коэффициенты активности ионов считать равными 1. БИЛЕТ 18
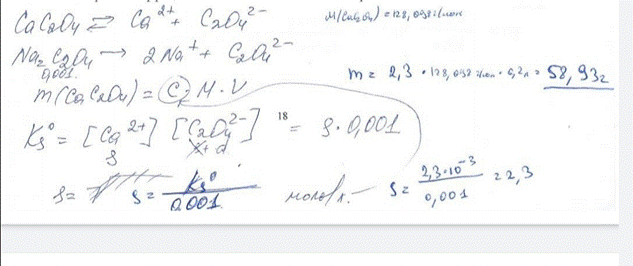
20. Рассчитайте активность ионов водорода в растворе, рН которого равен 5,3. БИЛЕТ 32
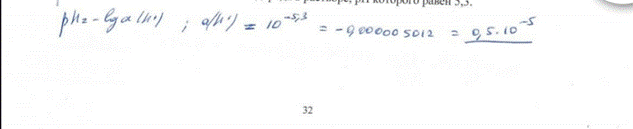
pH
21. Рассчитайте рН раствора, полученного при смешивании равных объемов 0,01 моль/л раствора кальция гидроксида и 0,025 моль/л раствора азотной кислоты.
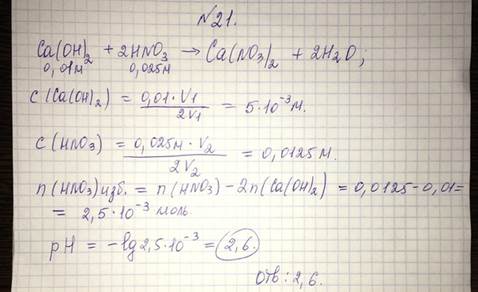
22. Рассчитайте рН раствора калия нитрита, содержащего 3,404 г соли в 200 мл раствора (pKa (HNO2) = 3,29).

23. Смешали 60 мл 0,1 моль/л уксусной кислоты (pKa = 4,76) и 40 мл 0,1 моль/л раствора натрия гидроксида. Чему равно значение рН полученного раствора?

24. Смешали 300 мл 0,05 моль/л раствора аммиака (pKb = 4,755) и 150 мл 0,1 моль/л раствора хлороводородной кислоты. Чему равно значение рНполученного раствора?
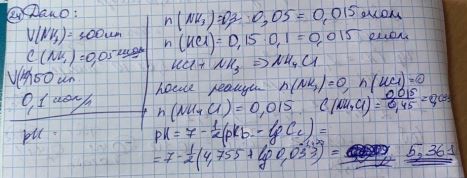
25. Рассчитайте рН раствора, полученного смешиванием 10,0 мл 0,0500 моль/л раствора муравьиной кислоты и 15,0 мл 0,0400 моль/л раствора натрия формиата (pKa = 3,75).

26. Рассчитайте рН 0,1 моль/л ацетата натрия (pKa (CH3COOH) = 4,76).
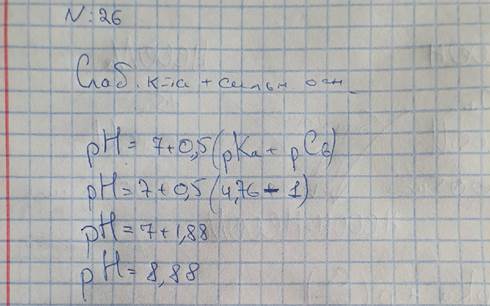
28. Рассчитайте, как изменится рН 0,10 моль/л раствора калия фторида, если к 50 мл этого раствора прибавить 200 мл воды. (pKa (HF) = 3,21).
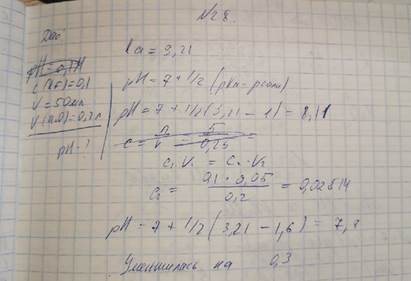
32. Смешали 60 мл 0,1 моль/л аммиака (pKb = 4,755) и 40 мл 0,1 моль/л раствора хлороводородной кислоты. Рассчитайте значение рН полученного раствора.

33. Смешали 70 мл 0,1 моль/л уксусной кислоты (pKa = 4,76) и 30 мл 0,1 моль/л раствора натрия гидроксида. Рассчитайте значение рН полученного раствора.

88. К 20,00 мл 0,1000 моль/л раствора аммиака (pKb = 4,755) в процессе титрования прибавили 19,98 мл 0,1000 моль/л раствора хлороводородной кислоты. Рассчитайте рН раствора в данный момент титрования.

91. Рассчитайте рН раствора в точке эквивалентности при титровании 10,00 мл 0,1000 моль/л раствора уксусной кислоты (pKa = 4,76) 0,1000 моль/л раствором натрия гидроксида.

27. Рассчитайте рН раствора, содержащего 3 г/л ортоборной кислоты. БИЛЕТ 51

29. Рассчитайте рН 0,025 моль/л раствора гидроксида натрия с учетом и без учета ионной силы раствора. БИЛЕТ 33
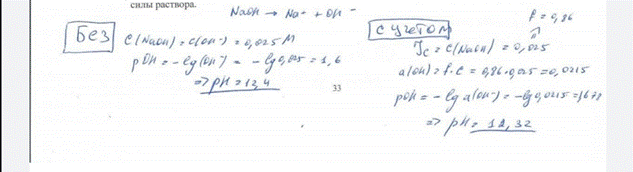
30. Рассчитать рН 0,1 моль/л раствора НСl с учетом и без учета ионной силы раствора. БИЛЕТ 45
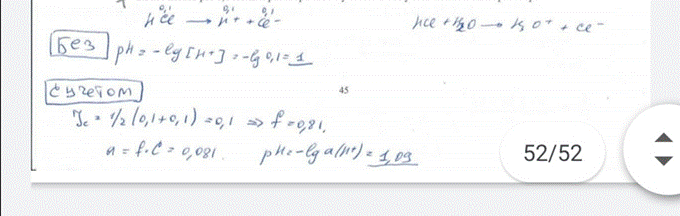
ОВ потенциал
34. Рассчитайте реальный окислительно-восстановительный потенциал электрода, опущенного в раствор, в котором молярные концентрации калия перманганата и марганца(II) сульфата равны, а рН равен 1. (Eo (MnO4‒/Mn2+) = 1,51 B).
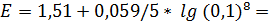 1,4156 В
1,4156 В
35. Рассчитайте, чему равен реальный окислительно-восстановительный потенциал электрода, опущенного в раствор, в котором молярные концентрации калия хлората и калия хлорида одинаковы, а рН равен 2. (Eo (ClO3‒/Cl–) = 1,45 B).
 1,332 В
1,332 В
36. Рассчитайте, чему равен реальный окислительно-восстановительный потенциал электрода, опущенного в раствор, в котором молярные концентрации калия бромата и калия бромида одинаковы, а рН равен 1. (Eo (BrO3‒/Br–) = 1,45 B).
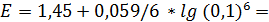 1,391 В
1,391 В
37. Рассчитайте, чему равен реальный окислительно-восстановительный потенциал электрода, опущенного в раствор, в котором молярные концентрации калия бромата и калия бромида одинаковы, а рН равен 2. (Eo (BrO3‒/Br–) = 1,45 B).
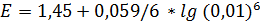 = 1,332 В
= 1,332 В
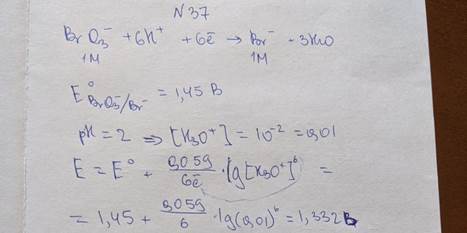
92. К 10,0мл 0,0700моль/л раствора церия(IV) сульфата прибавили 20,0млраствора железа(II) сульфата с молярной концентрацией 0,0500моль/л. Рассчитайте реальный окислительно-восстановительный потенциал полученного раствора. Eo (Fe3+/Fe2+) = 0,771 B, Eo (Ce(SO4)32‒/Ce3+) = 1,44 B.

93. К 15,0мл 0,0700моль/л раствора церия(IV) сульфата прибавили 20,0млраствора железа(II) сульфата с молярной концентрацией 0,0500моль/л. Рассчитайте реальный окислительно-восстановительный потенциал полученного раствора. Eo (Fe3+/Fe2+) = 0,771 B, Eo (Ce(SO4)32‒/Ce3+) = 1,44 B.3.

Гравиметрия
43. Рассчитайте массу цинка в анализируемом образце, если масса гравиметрической формы Zn2P2O7 равна 0,2081 г, а гравиметрический фактор (F) равен 0,4292.
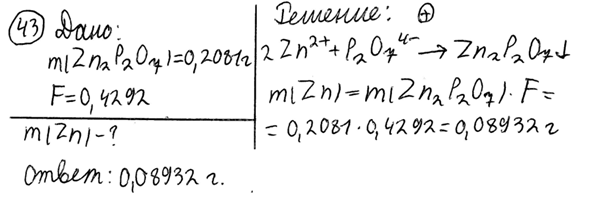
44. Рассчитайте гравиметрический фактор (F) при определении алюминия оксида (М (Al2O3) = 101,96 г/моль), если гравиметрическая форма – алюминий оксихинолинат (М (Al(C9H6ON)3) = 459,44 г/моль).
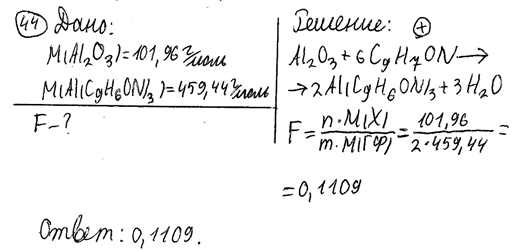
Разбавление
50. Рассчитайте, до какого объема надо разбавить 150 мл раствора калия перманганата с молярной концентрацией эквивалента 0,355 моль/л для получения раствора с титриметрическим фактором пересчета по водорода пероксиду, равным 0,001816 г/мл (M (H2O2) = 34,0147).
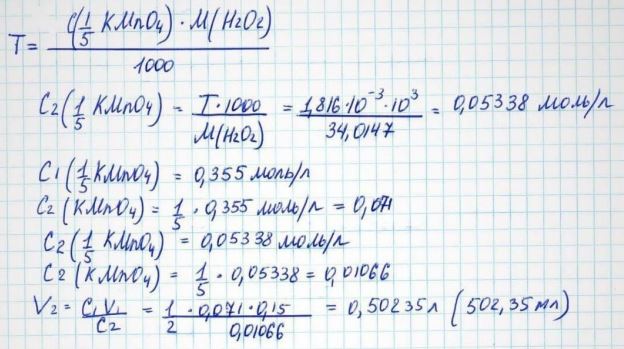
77. Рассчитайте, до какого объема надо разбавить 120 мл раствора калия перманганата с молярной концентрацией эквивалента 0,35 моль/л для получения раствора с титриметрическим фактором пересчета по водорода пероксиду, равным 0,001816 г/мл (M (H2O2) = 34,0147).

66. До какого объема (в мл) следует разбавить 250,0мл раствора калия дихромата с молярной концентрацией 0,02555 моль/лдля получения раствора с титриметрическим фактором пересчета калия дихромата по железу(II) (М = 55,847), равным 3,839∙10–3 г/мл?

67. До какого объема (в мл) следует разбавить 167,0мл0,1179моль/л раствора церия(IV) сульфата для получения раствора с титриметрическим фактором пересчет а церия(IV) сульфата (М = 333,24) по железу(II) (М = 55,847), равным 4,381·10–3 г/мл?

65. Какой объем (мл) раствора аммония тиоцианата с молярной концентрацией 0,2010 моль/л нужно взять для получения 200,0 мл раствора с титриметрическим фактором пересчета по серебра нитрату, равным 3,500.10‒3 г/мл (М (AgNO3) = 169,873)?

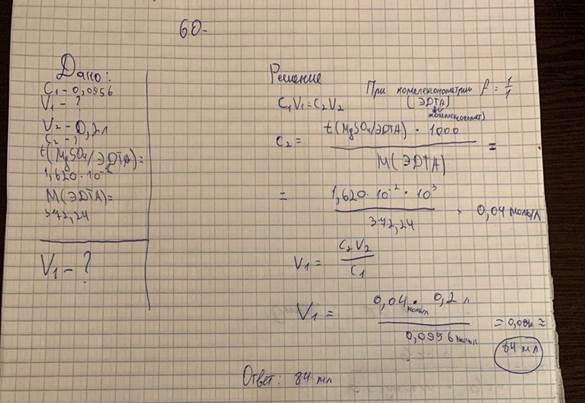
60. Какой объем (мл) раствора магния сульфата с молярной концентрацией 0,0956 моль/л необходимо взять для приготовления 200,0 мл раствора магния сульфата с титриметрическим фактором пересчета по ЭДТА равным 1,620‧10‒2 г/мл (М (ЭДТА) = 372,24)?
Легкие
51. Рассчитайте массу навески безводного натрия карбоната, необходимую для приготовления 500 мл раствора с молярной концентрацией 0,1000 моль/л (М (Na2CO3) = 105,989).

59. В каком объеме (мл) следует растворить навеску цинка сульфата массой 8,0720 г, чтобы получить раствор с молярной концентрацией соли 0,0500 моль/л (M (ZnSO4) = 161,45)?
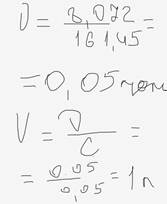
62. Рассчитайте молярную концентрацию эквивалента раствора щавелевой кислоты, если в 200,0 мл раствора содержится 0,5150 г щавелевой кислоты дигидрата (М = 126,066).
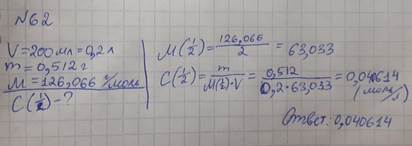
поправочный коэффициент
48. Рассчитайте поправочный коэффициент для 0,1 моль/л раствора хлороводородной кислоты, если при стандартизации этого раствора на титрование 25,00 мл раствора натрия тетрабората с молярной концентрацией эквивалента 0,1050 моль/л израсходовано 23,05 мл стандартизируемого раствора.
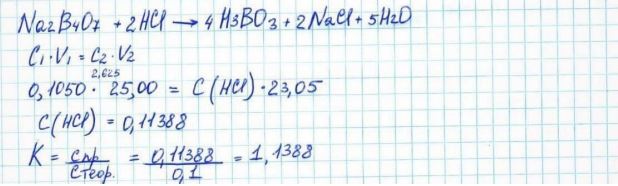
80. Рассчитайте поправочный коэффициент для 0,1 моль/л раствора хлороводородной кислоты, если при стандартизации этого раствора на титрование 10,00 мл раствора натрия тетрабората с молярной концентрацией эквивалента 0,1050 моль/л израсходовано 12,55 мл стандартизируемого раствора.

 2020-08-05
2020-08-05 7478
7478







