52. Рассчитайте титриметрический фактор пересчета раствора калия бромата по сурьме(III) для раствора, полученного разбавлением 100,0 мл раствора с молярной концентрацией эквивалента KBrO3 0,05000 моль/л до 1,000 л (M (Sb(III)) = 60,875).

53. На титрование 25,00 мл раствора цинка сульфата с молярной концентрацией 0,05424 мль/л израсходовано 18,52 мл раствора ЭДТА. Вычислите титриметрический фактор пересчета ЭДТА (мг/мл) по кальция хлориду (М = 110,984).

56. Рассчитайте, до какого объема надо разбавить 120 мл раствора калия перманганата с молярной концентрацией эквивалента 0,35 моль/л для получения раствора с титриметрическим фактором пересчета по водорода пероксиду, равным 0,001816 г/мл (M (H2O2) = 34,0147).

61. Рассчитайте титриметрический фактор пересчета раствора титранта – натрия тиосульфата (M = 158,11) по иоду (М = 253,809), если молярная концентрация раствора натрия тиосульфата 0,1045 моль/л.

76. Рассчитайте титриметрический фактор пересчета раствора бария гидроксида по соляной кислоте, если раствор приготовлен растворением навески бария гидроксида октагидрата массой 0,9656 г в объеме 200,0 мл (M (Ba(OH)2.8H2O) = 315,464, M (HCl) = 36,461).

Титрование
75. Навеску металлического магния (М = 24,3050) массой 0,1256 г растворили в серной кислоте, и полученный раствор оттитровали раствором ЭДТА в присутствии аммиачного буфера, израсходовав 10,15 мл титранта. Вычислите титр (в г/мл) раствора ЭДТА (безводной соли) (М = 336,21).
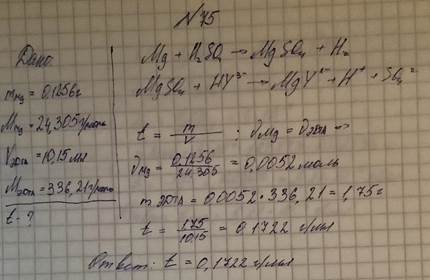
Заместительное
54. Для определения кальция(II) методом заместительного титрования к 10,00 мл анализируемого раствора, содержащего соль кальция, прибавили избыток комплекса магния с ЭДТА. Полученный раствор оттитровали раствором ЭДТА с молярной концентрацией 0,1000 моль/л и поправочным коэффициентом 1,020, израсходовав 10,85 мл титранта. Вычислите массу (в граммах) кальция (М = 40,078) в 100,0 мл анализируемого раствора.

ОВР
63. Вычислите массовую долю водорода пероксида (М = 34,0147) в растворе в %, если на титрование 2,5млэтого раствора (плотность 1,0 г/мл) было затрачено 18,95мл раствора калия перманганата с молярной концентрацией 0,01010моль/л.

64. Навеску оксида мышьяка(III) массой 0,0650 г (М = 197,841) перевели в раствор, добавили натриягидрокарбонат и затем оттитровали 15,25млраствора иода в калия иодиде. Вычислите молярную концентрацию эквивалента титранта в растворе.

72. Навеску оксида мышьяка(III) массой 0,0850 г (М = 197,841) перевели в раствор, добавили натриягидрокарбонат и затем оттитровали 15,00млраствора иода в калия иодиде. Вычислите молярную концентрацию эквивалента титранта в растворе.

83. На титрование 20,00мл раствора щавелевой кислоты с молярной концентрацией 0,02500моль/л было израсходовано в сернокислой среде 18,00мл раствора калия перманганата. Вычислите молярную концентрацию эквивалента титранта в растворе.

Кислотно основное
82. На титрование 20,00 мл раствора натрия карбоната с молярной концентрацией 0,05000 моль/л в присутствии фенолфталеина было израсходовано 12,05 мл соляной кислоты. Вычислите молярную концентрацию соляной кислоты. 0,16598
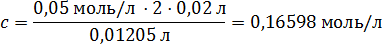
84. Образец натрия гидроксида, загрязненный натрия карбонатом и индифферентными примесями, растворили в воде и получили 100,0 мл раствора. Аликвотную долю 10,00 мл оттитровали раствором соляной кислоты с молярной концентрацией 0,1044 моль/л. В присутствии фенолфталеина было затрачено 11,89 мл титранта, а в присутствии метилового оранжевого 12,79 мл. Вычислите массу натрия гидроксида в образце в граммах.
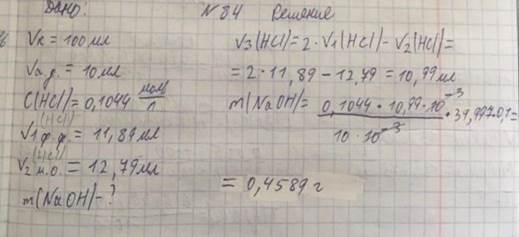
90. Раствор НСI с концентрацией 0,1 моль/л титруют раствором КОН такой же концентрации. Рассчитайте рН раствора в начальный момент титрования и при добавлении к 20,00 мл. раствора НСI 19,90 мл и 20,50 мл титранта. 1; 3,6; 11,1
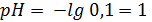
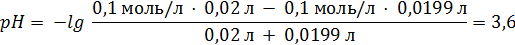
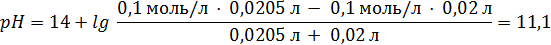
Просто дичь
94. К 20,00 мл 0,1250 моль/л раствора серебра нитрата прибавили 25,00мл 0,1000моль/л раствора калия тиоцианата. Рассчитайте рАg полученного раствора. pKs (AgSCN) = 11,97.
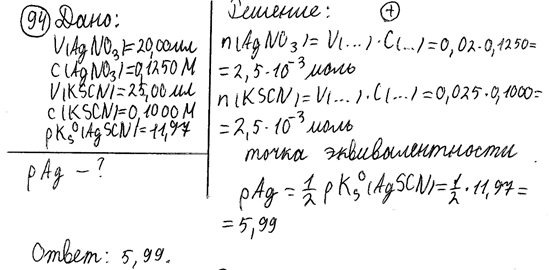
95. Рассчитайте pI при титровании 10 мл 0,05000 моль/л раствора калия иодида раствором серебра нитрата с такой же молярной концентрацией, если титранта добавлено 9,90 мл. pKs (AgI) = 16,08.
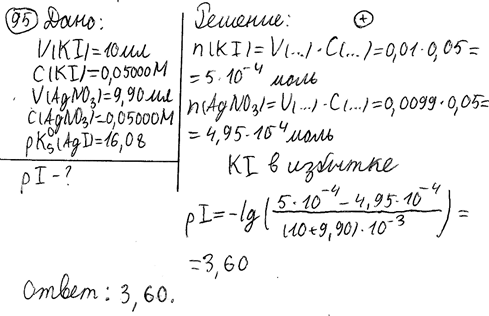
96. К 10,00 мл 0,05250 моль/л раствора серебра нитрата прибавили 11,5мл 0,04505 моль/л раствора натрия хлорида. Рассчитайте рАg полученного раствора. pKs (AgCl) = 9,75.
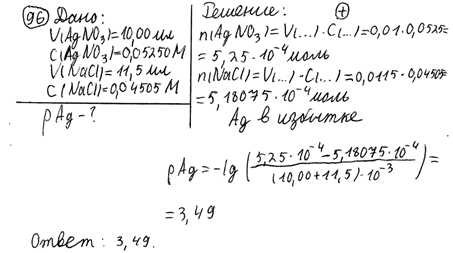
97. К 10,00 мл 0,05000 моль/л раствора калия бромида прибавили 9,00 мл 0,05500 моль/л раствора серебра нитрата. Рассчитайте рВr полученного раствора. pKs (AgBr) = 12,28.
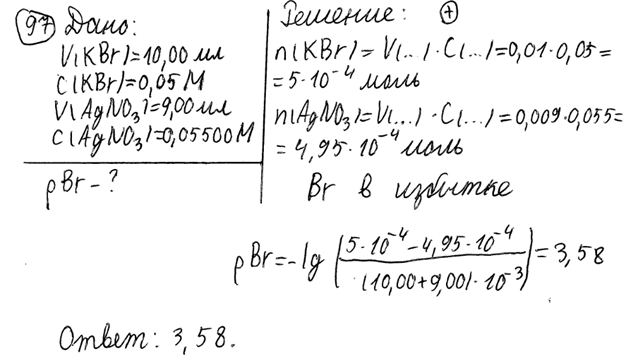
2. Предельная концентрация ионов меди(II) для реакции обнаружения ее с купроном составляет 2,0‧10-6 г/мл, а минимальный объем раствора равен 0,05 мл. Вычислите предел обнаружения ионов меди(II) для данной реакции и молярную концентрацию данного раствора. БИЛЕТ 2
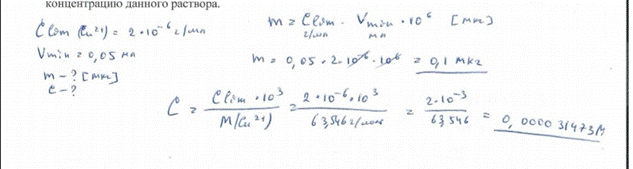
3. Предел обнаружения ионов натрия в виде нонагидрата нонацетата натрия-цинка триуранила равен 0,125 мкг в капле 0,05 мл. Чему равно предельное разбавление при данной реакции? БИЛЕТ 15
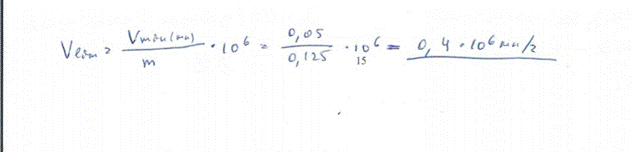
4. Предельное разбавление реакции обнаружения ионов калия в виде гексахлороплатината(IV) калия равно 1·104 мл/г. Определите предел обнаружения иона калия, если реакция удается в объеме раствора 0,05 мл. БИЛЕТ 17
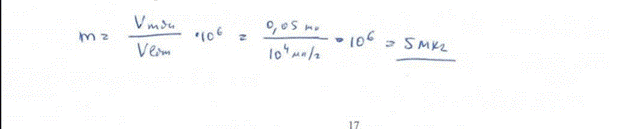
5. При обнаружении иона серебра в виде хромата серебра реакция удается с 0,02 мл 0,0004 моль/л раствора нитрата серебра. Вычислите предел обнаружения и предельное разбавление для данной реакции. БИЛЕТ 6
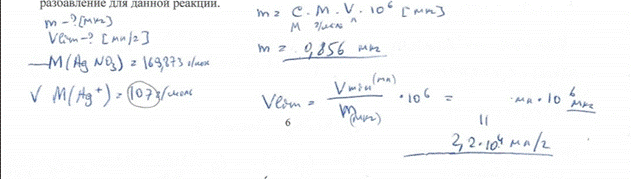
6. Предельная концентрация ионов калия, обнаруживаемая с гидротартратом натрия, равна 1,2·10-3 г/мл. Чему равна наименьшая молярная концентрация раствора хлорида каля, в котором ион калия может быть обнаружен данной реакцией? БИЛЕТ 9
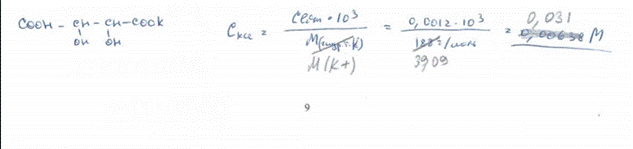
7. Вычислите Кs° свежеосажденного гидроксида магния, если в 500 мл его насыщенного раствора содержится 1,55·10-2 г этого соединения. БИЛЕТ 20
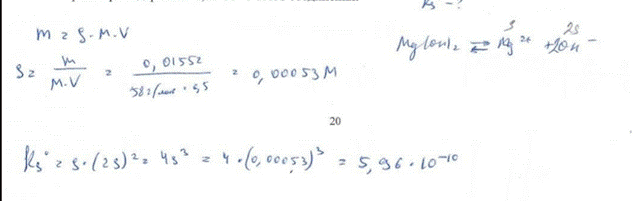
9. Как изменится молярная растворимость иодида серебра, если к его насыщенному водному раствору добавить йодид калия до концентрации 1,0·10-4 моль/л? БИЛЕТ 7

10. Рассчитайте молярную растворимость бромида серебра в 0,10 моль/л растворе бромида стронция: а) без учета ионной силы раствора; б) с учетом ионной силы раствора. БИЛЕТ 21
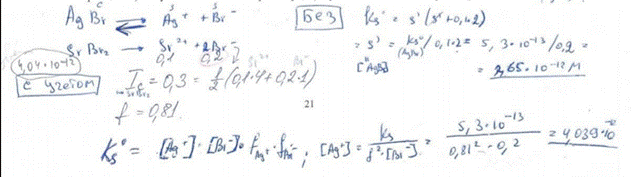
11. Вычислите КS° хлорида серебра, если молярная концентрация его насыщенного раствора равна 1,33·10-5 моль/л. БИЛЕТ 25

12. Рассчитайте молярную концентрацию ионов свинца и иодид-ионов в насыщенном растворе иодида свинца. билет 42 БИЛЕТ 42
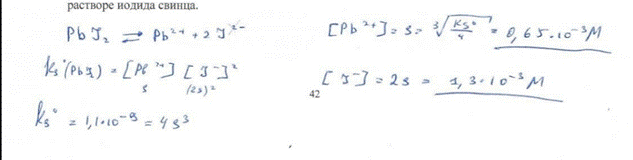
13. Как изменится растворимость оксалата кальция в присутствии 0,10 моль/л раствора хлорида калия по сравнению с его растворимостью в воде. билет 39
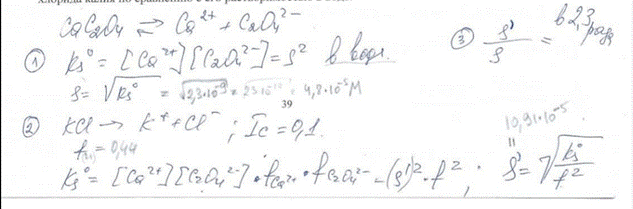
15. Рассчитайте ионную силу раствора, полученного при смешивании равных объемов 0,060 моль/л растворов сульфата аммония, хлорида аммония и аммиака. БИЛЕТ 16

19. Рассчитайте активность сульфат-ионов в 0,050 моль/л растворе сульфата цинка. билет 43 БИЛЕТ 43
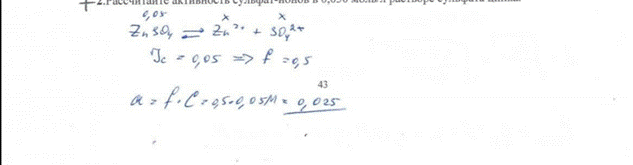
31. Рассчитайте концентрацию формиат-ионов в 0,050 моль/л растворе муравьиной кислоты. БИЛЕТ 44
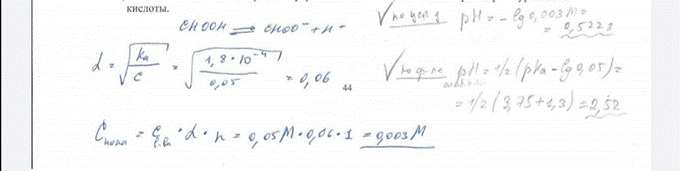
33. Рассчитайте отношение молярных концентраций муравьиной кислоты и ее натриевой соли в формиатном буферном растворе, имеющем рН 3,15. БИЛЕТ 47

38. Чему равно отношение активных концентраций окисленной и восстановленной форм редокс-пары Fe3+/Fe2+ в растворе, если условный окислительно-восстановительный потенциал этой редокс-пары составляет 0,71В? БИЛЕТ 49
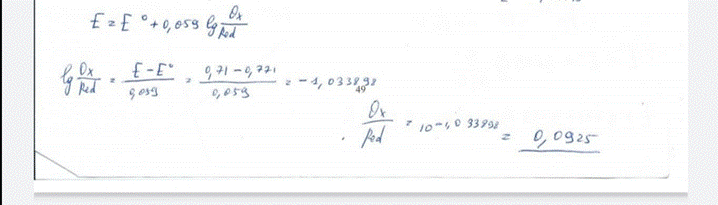
39. Рассчитайте равновесную концентрацию ионов серебра(I) в 0,10 моль/л растворе К[Ag(S2O3)]. Коэффициенты активности ионов принять равными 1. БИЛЕТ 4
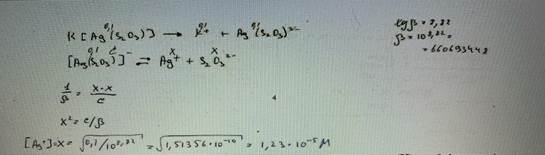
40. Чему равна равновесная концентрация ионов кадмия(II) в 0,1 моль/л растворе K2[Cd(CN)4], содержащем KCN в концентрации 1,0 моль/л. Ионную силу раствора принять равной 0. БИЛЕТ 46
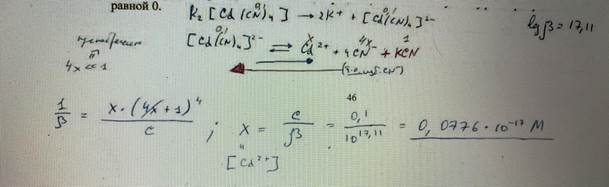
41. Чему равна равновесная концентрация ионов алюминия(III) в 1,0 моль/л растворе Na[Al(OH)4] при рН = 11? Величину ионной силы раствора принять равной 0. БИЛЕТ 40
42. Как изменится равновесная концентрация ионов цинка(II) в 1,0 моль/л растворе Na2[Zn(OH)4], если рН раствора увеличить от 11 до 12? БИЛЕТ 48

45. При анализе стандартного образца дигидрата бария хлорида получены следующие значения массовой доли бария в образце в %: 56,10; 56,18; 56,10 и 56,14. Рассчитайте доверительный интервал для среднего результата этого анализа с доверительной вероятностью 0,95. Укладывается ли действительное значение определяемой величины, вычисленное, исходя из химической формулы анализируемой соли, в этот интервал? Если действительное значение выходит за пределы интервала, найдите чему равна систематическая погрешность определения. БИЛЕТ 3

46. При проведении 5 параллельных определений кальция в образце методом комплексонометрии получены следующие значения массовой доли определяемого компонента, %: 3,01; 3,16; 3,08; 3,04; 3,11. Рассчитайте среднее значение и представьте полученный результат в виде границ доверительного интервала с доверительной вероятностью, равной 0,95. БИЛЕТ 24
47. Рассчитайте объем, в котором надо растворить навеску гидроксида бария массой 0,8667 г, чтобы получить раствор с молярной концентрацией эквивалента 0,1000 моль/л. БИЛЕТ 1

49. Вычислите молярную концентрацию соляной кислоты, если на титрование 0,1995 г натрия тетрабората декагидрата (М = 381,372) было затрачено 22,50 мл этой кислоты. БИЛЕТ 11 И 52 НО ДРУГИЕ ЦИФРЫ
55. Вычислите молярную концентрацию раствора HCI, если на титрование 0,0976 г Nа2В4О7 ‧10Н2О было затрачено 21,55 мл этого раствора. БИЛЕТ 52
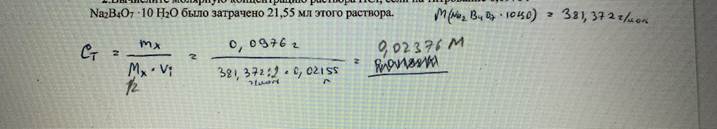
57. Найти титр раствора серной кислоты, если на титрование навески карбоната лития массой 0,1551 г было затрачено 18,18 мл этого раствора (индикатор – метилоранж). БИЛЕТ 13
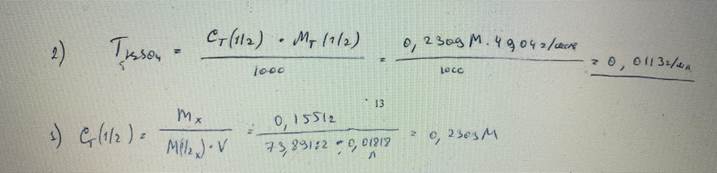
58. Вычислите, какой объем раствора хлороводородной кислоты с плотностью 1,129 г/см3 потребуется для приготовления 1500 мл раствора с титриметрическим фактором пересчета по КОН, равным 1,260‧10-2 г/мл. БИЛЕТ 14
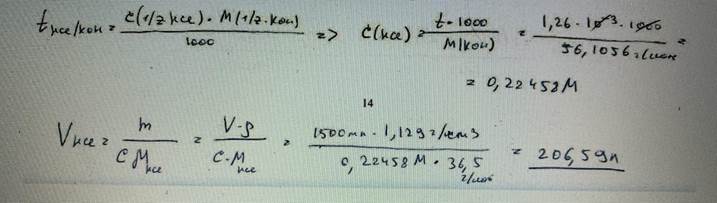
68. Навеску калия бромата массой 2,5000 г растворили в воде и получили 500,0 мл раствора. Определите молярную концентрацию эквивалента раствора и титр по оксиду мышьяка(III). БИЛЕТ 27
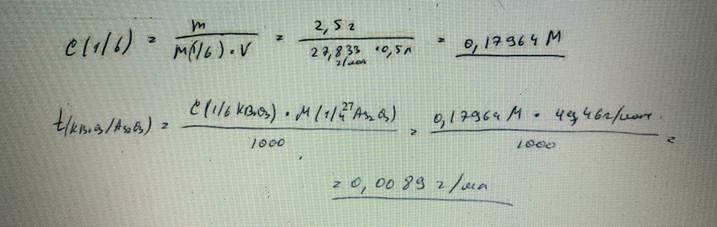
69. Вычислите массу КОН, содержащегося в навеске, если на ее титрование было израсходовано 19,44 мл. раствора серной кислоты с молярной концентрацией эквивалента 0,1410 моль/л. БИЛЕТ 28
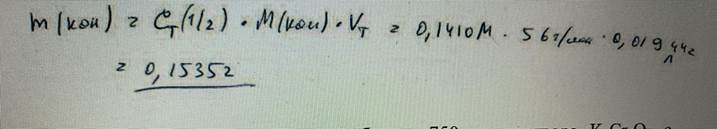
70. До какого объема следует разбавить 750 мл раствора K2Cr2O7 c молярной концентрацией эквивалента 0,1533 моль/л для получения раствора с титриметрическим фактором пересчета по Fe(II), равным 3,839·10-3 г/мл? БИЛЕТ 29
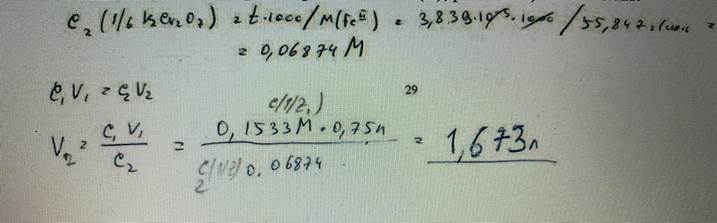
71. Вычислите навеску хлорида сурьмы(III), если при броматометрическом титровании в сильнокислой среде было израсходовано 18,00 мл раствора КВrО3 с молярной концентрацией 0,01000 моль/л. БИЛЕТ 31
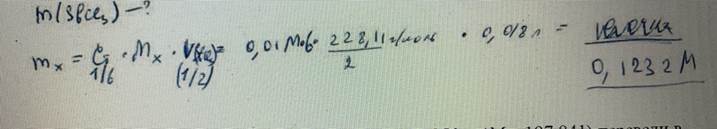
78. Вычислите молярную концентрацию раствора НCI, если на титрование 0,0860 г Na2B4O7·10H2O было затрачено 21,05 мл этого раствора. БИЛЕТ 11 И 52 НО ДРУГИЕ ЦИФРЫ

79. Определите молярную концентрацию эквивалента раствора дихромата калия, если навеска дихромата калия массой 1,2230 г была растворена в мерной колбе емкостью 500 мл. БИЛЕТ 41

87. 20,00 мл раствора KOH с концентрацией 0,1 моль/л титруют раствором HCI такой же концентрации. Рассчитайте pH раствора при добавлении 18,00 мл и 20,02 мл титранта. БИЛЕТ 5

89. Раствор НСI с концентрацией 0,1 моль/л титруют раствором КОН такой же концентрации. Рассчитайте рН раствора при добавлении к 20,00 мл. раствора НСI 19,80 мл и 20,02 мл титранта. БИЛЕТ 34

 2020-08-05
2020-08-05 15896
15896







