Цель работы: определить отношение теплоемкости воздуха при постоянном давлении к теплоемкости воздуха при постоянном объёме; изучить термодинамические процессы в газах.
ВВЕДЕНИЕ
Теплоемкостью тела СТ называется величина, равная количеству теплоты 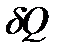 , необходимому для нагревания вещества на 1 К:
, необходимому для нагревания вещества на 1 К:
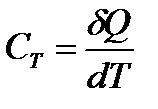 . (1)
. (1)
Обозначение 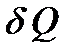 говорит о том, что теплота есть функция процесса.
говорит о том, что теплота есть функция процесса.
Удельной теплоемкостью вещества Суд называется величина, равная количеству теплоты 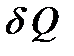 , необходимому для нагревания 1 кг вещества на 1 К:
, необходимому для нагревания 1 кг вещества на 1 К:
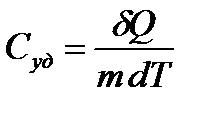 . (2)
. (2)
Молярной теплоемкостью вещества Смол называется величина, равная количеству теплоты 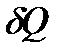 , необходимому для нагревания 1 моль вещества на 1 К:
, необходимому для нагревания 1 моль вещества на 1 К:
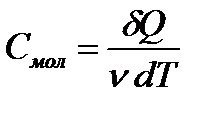 . (3)
. (3)
Величины Суд и Смол являются характеристиками вещества и зависят от процесса, в котором веществу сообщается теплота 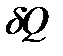 . Различают теплоемкости при постоянном объёме СV и постоянном давленииСР, если в процессе нагревания вещества его объём или давление поддерживаются постоянными.
. Различают теплоемкости при постоянном объёме СV и постоянном давленииСР, если в процессе нагревания вещества его объём или давление поддерживаются постоянными.
Если нагревать вещество при постоянном объёме, то все количество теплоты, сообщаемое веществу, полностью идет на увеличение его внутренней энергии. Если нагревать вещество при постоянном давлении, то количество теплоты, сообщаемое веществу, идет на увеличение его внутренней энергии и на работу изобарического расширения, поэтому СР больше, чем СV. Молярные теплоемкости СРмол и СVмол связаны между собой уравнением:
СРмол - СVмол = R, (4)
где R – универсальная газовая постоянная.
Уравнение (4) называется уравнением Майера.
При постоянном объёме: 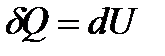 , здесь
, здесь 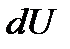 - изменение внутренней энергии. Такое обозначение говорит о том, что внутренняя энергия есть функция процесса. Поскольку изменение внутренней энергии равно:
- изменение внутренней энергии. Такое обозначение говорит о том, что внутренняя энергия есть функция процесса. Поскольку изменение внутренней энергии равно:
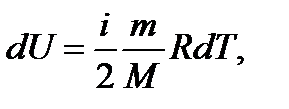 (5)
(5)
то, сопоставляя (3) и (5), получим:
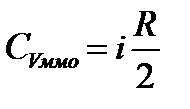 , (6)
, (6)
здесь 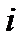 - число степеней свободы. С учетом (4) имеем:
- число степеней свободы. С учетом (4) имеем:
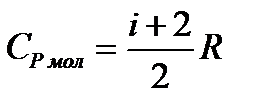 . (7)
. (7)
Существует две формы передачи энергии от одних тел к другим: теплота и работа. Опыт показывает, что, в соответствии с законом сохранения энергии, при любом способе перехода системы из первого состояния во второе изменение внутренней энергии 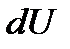 будет одинаковым и равным разности между количеством теплоты
будет одинаковым и равным разности между количеством теплоты 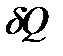 , полученным системой и работой
, полученным системой и работой 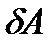 , совершаемой системой против внешних сил. Отсюда следует, что:
, совершаемой системой против внешних сил. Отсюда следует, что:
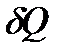 =
= 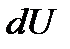 +
+ 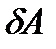 . (8)
. (8)
Уравнение (8) выражает первый закон термодинамики: количество теплоты, сообщаемое системе, идет на изменение её внутренней энергии и на совершение системой работы против внешних сил.
Среди различных термодинамических процессов чаще рассматриваются следующие:
1 - изохорный: 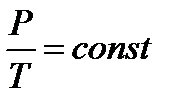 - закон Шарля.
- закон Шарля.
2 - изобарный: 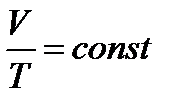 - закон Гей-Люссака.
- закон Гей-Люссака.
3 - изотермический: 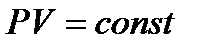 - закон Бойля-Мариотта.
- закон Бойля-Мариотта.
4 - адиабатный: 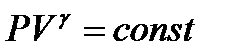 - закон Пуассона, здесь g - показатель адиабаты, равный отношению теплоемкостей:
- закон Пуассона, здесь g - показатель адиабаты, равный отношению теплоемкостей:
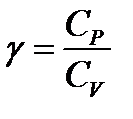 . (9)
. (9)
ОПИСАНИЕ ЛАБОРАТОРНОЙ УСТАНОВКИ
Определение показателя адиабаты g в настоящей работе производится следующим методом: исследуемый газ (воздух) заданной массы последовательно проходит через три различных состояния (рис. 1). Из состояния 1 в состояние 2 газ переходит путем адиабатного расширения, из 2 в 3 – путем изохорного нагревания. Процесс 3 - 1 является изотермическим.
| Р Р1 Р3 Р2 |
| 0 V1 V2 V |
| 1 |
| 3 |
| 2 |
| Б |
| Н |
| ИБ |
| ПК К |
Рис. 1. Рис. 2.
Установка для определения величины 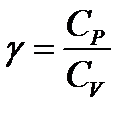 изображена на рис. 2. Установка состоит из баллона Б, в который можно накачивать воздух насосом Н. Для сообщения баллона с атмосферой служит кран К. Для проведения измерений служит измерительный блок ИБ, соединенный с компьютером ПК.
изображена на рис. 2. Установка состоит из баллона Б, в который можно накачивать воздух насосом Н. Для сообщения баллона с атмосферой служит кран К. Для проведения измерений служит измерительный блок ИБ, соединенный с компьютером ПК.
Покажем, как опытным путем можно найти показатель адиабаты g. Пусть в баллоне объёмом V1 находится при комнатной температуре сжатый воздух, его давление 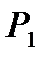 . На рис. 1 этому состоянию соответствует точка 1. Если соединить баллон с атмосферой (открыть кран К), то воздух адиабатически расширяется и его температура уменьшается (процесс 1 - 2). Когда давление в баллоне станет
. На рис. 1 этому состоянию соответствует точка 1. Если соединить баллон с атмосферой (открыть кран К), то воздух адиабатически расширяется и его температура уменьшается (процесс 1 - 2). Когда давление в баллоне станет 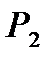 (давление не уменьшать до 0), надо закрыть кран К. После этого оставшийся воздух в баллоне станет изохорически нагреваться до комнатной температуры, при этом давление увеличивается до Р 3 (см. рис. 1). Точки 1 и3 соответствуют комнатной температуре, т.е. процесс 1 - 3, изображенный на рис. 1, является изотермическим, запишем для него закон Бойля - Мариотта:
(давление не уменьшать до 0), надо закрыть кран К. После этого оставшийся воздух в баллоне станет изохорически нагреваться до комнатной температуры, при этом давление увеличивается до Р 3 (см. рис. 1). Точки 1 и3 соответствуют комнатной температуре, т.е. процесс 1 - 3, изображенный на рис. 1, является изотермическим, запишем для него закон Бойля - Мариотта:
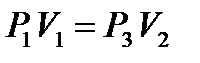 . (10)
. (10)
Процесс 1 - 2 является адиабатным, запишем для него уравнение Пуассона:
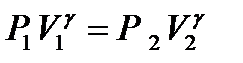 . (11)
. (11)
Из уравнений (10) и (11) определим g. Возведем уравнение (10) в степень g и разделим его на (11), тогда получим:
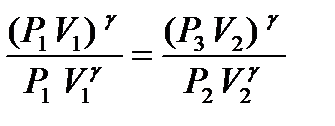 или
или 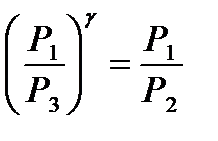 . (12)
. (12)
Прологарифмируем (12) и получим выражение для показателя адиабаты:
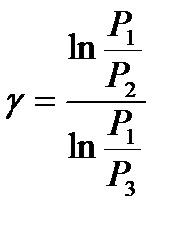 . (13)
. (13)
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
1. Закрыть кран К. Накачать воздух в баллон Б так, чтобы давление поднялось до значения Р1 (25 - 30 кПа). Выждать около 3 минут, тогда давление практически перестанет меняться. Сделать отсчет Р1 и записать его в таблицу 1.
Таблица 1
| № | Р1, кПа | Р2, кПа | Р3, кПа | 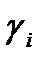
| <g> | gтеор |
| 1 | ||||||
| 2 | ||||||
| … | ||||||
| 6 |
2. Быстро открыть кранК, при этом воздух выходит из баллона (до конца накачанный воздух не выпускать). Зафиксировать давление Р2 и закрыть кран, при этом давление в баллоне будет увеличиваться. Выждать около 3 минут, пока давление в баллоне не перестанет меняться. Сделать отсчет давления Р3. Повторить измерения по пунктам (1) и (2) еще 5 раз. Все полученные данные записать в таблицу 1.
ОБРАБОТКА РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ
1. По экспериментальным данным, используя формулу (13), определить 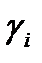 , затем среднее значение
, затем среднее значение 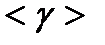 .
.
2. Используя формулы (6), (7), (9), вычислить теоретическое значение 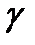 теор, считая воздух двухатомным газом.
теор, считая воздух двухатомным газом.
КОНТРОЛЬНЫЕ ВОПРОСЫ ДЛЯ СДАЧИ РАБОТЫ
1. Что называется теплоемкостью вещества, молярной теплоемкостью, удельной теплоемкостью?
2. Как связаны между собой молярная и удельная теплоёмкости?
3. Сформулируйте первый закон термодинамики. Запишите первый закон термодинамики для различных изопроцессов.
4. Запишите уравнение Пуассона.
 2020-08-05
2020-08-05 165
165








