где I ток в контуре
гамма контур, по которому идет интегрирование
r0 произвольная точка
Возьмём элементарный участок проводника с током dl, он будет создавать в некоторой точке индукцию магнитного поля dB. dl это элементарный вектор направление, которого совпадает с направлением тока в контуре. r радиус вектор, направленный от dl к точке наблюдения. А вектор dB направлен перпендикулярно элементарному участку проводника dl и одновременно перпендикулярно радиус вектору r.
То есть, проще говоря, элементарный вектор индукции dB направлен перпендикулярно плоскости образованной вектором dl и r. А его направление совпадает с направлением касательной к магнитной индукции. Определить это направление можно с помощью правела правого винта. Применяется оно таким образом.
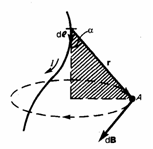
Рисунок 1 — иллюстрация к закону Био Савара Лапласа
В случае если поступательное движение винта направлено в сторону движения тока, то направление вращения головки винта указывает направление dB.
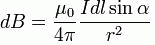
Формула 2 — определяет модуль вектора dB
где альфа это угол между векторами элементарного участка цепи dl и радиус-вектором r.
Закон Фарадея
Закон Фарадея [по имени англ. физика М. Фарадея (1791—1867)] — основные законы электролиза. Устанавливают взаимосвязь между количеством электричества, проходящего через электропроводящий раствор (электролит), и количеством вещества, выделяющегося на электродах.
Первый закон: масса m вещества, выделившегося на электроде, при прохождении электрического тока прямо пропорциональна значению q электрического заряда, пропущенного через электролит; m=kq, где k — электрохимический эквивалент вещества, численно равный массе вещества, выделившегося при прохождении через электролит единицы количества электричества. При пропускании через электролит постоянного тока I в течение секунды q=It и m=kIt.
Второй закон: отношение массы различных веществ, претерпевающих химические превращения на электродах при прохождении одинаковых электрических зарядов, равно отношению химических эквивалентов этих веществ. Отношение молярной массы A элемента к его валентности n называется химическим эквивалентом; количество вещества, масса которого, выраженная в граммах, равна, его химическому эквиваленту, — грамм-эквивалентом; величина F — числом Фарадея; F=96486,70±0,54 Кл/моль.
 2020-08-05
2020-08-05 114
114








