Специфичность.
Т.к. ДНК-полимераза може удлинять не те фрагменты, что выбраны исследователем, а также праймеры-димеры, то один из способов достижения высокой специфичности работы ДНК-полимеразы - это проведени реакции на льду (оne way to reduce nonspecific amplification is to set up PCR on ice). Другое решение проблемы - это добавление ДНК-полимеразы до стадии отжига во время первого этапа. Эта техника называется "горячий старт" (“hot start”). Вот два результата ПЦР-реакции для сравнения эффективности двух техник:
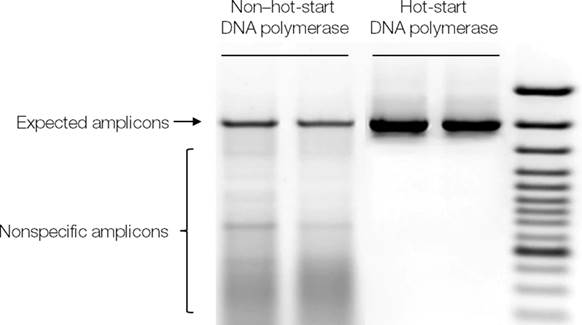
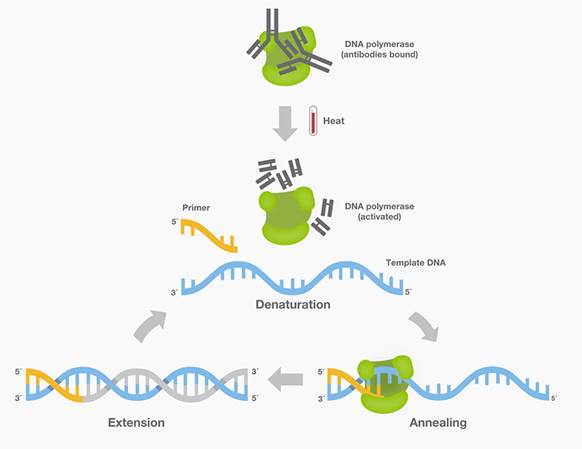
В 1994 была применена Taq-полимераза с характеристиками настоящего "горячего старта". В данном случае к полимеразе прикреплены антитела, которые ингибируют фермент при комнатной температуре. В течении высокотемпературного этапа денатурации (более 90 градусов Цельсия) антитела деградируют, и ДНК-полимераза активируется.
Термостабильность (thermostability)
Первоначально Taq-полимераза была получена из тремофильных бактерий. Такой фермент может выдерживать высокую температуру (90 градусов), но время его полураспада при более высокой температуре значительно снижается. Это особенно опасно при денатурации ДНК в ее вторичной конформации и при наличии большого количества CG-нуклеотидов. Именно поэтому гипертермостабильные ферменты, такие как Pfu-полимераза (при 95 градусах в 20 раз стабильнее Taq-полимеразы) стали надежным инструментом для исследователей.
Высокая надежность (fidelity)
Под высокой надежность относительно ДНК-полимеразы понимается высокая точность (пруфридинг) репликации. Это свойство чрезвычайно важно для таких процедур, как клонирование, секвенирование и сайт-специфичный мутагенез (site-directed mutagenesis).
Процессивность (processivity)
Процессивность фермента определяется как количество нуклеотидов, процессированных (?) в течение одного акта присоединения (of nucleotides being processed in a single binding event). Процессивность ДНК-полимеразы часто отражает скорость и синтеза, а также сродство (affinity) к субстрату. Следовательно, ДНК-полимеразы высокой процессивностью эффективны для амплификации длинных матриц и последовательностей со вторичной структурой и высоким CG-содержанием, а также в случае присутствия в образце таких ингибиторов ПЦР, как гепарин, ксилан, а также humic acid.
Ненадежность при работе Taq-полимеразы может составлять от 10^-6 (высокая надежность) до 10^-4 (низкая надежность) ошибок на вставленный нуклеотид. Taq polymerase errors in PCR:
("Taq polymerase errors in PCR:
Frequency and management" by
Xavier Foissac, UMR Fruit Biology and Pathology)
---
Строение нуклеиновых кислот. Предшественники биосинтеза нуклеиновых кислот. 3’- и 5’ концы цепей нуклеиновых кислот. Формы структуры ДНК. Репликация ДНК прокариот и эукариот, особенности репликации, синтез одной и второй цепи – основные различия. Образование праймеров, удаление праймеров, принцип лигирования. ДНК-полимеразы организмов, их полимеразная и экзонуклеазная активность. Решение проблемы синтеза антипараллельных цепей при однонаправленном движении вилки репликации. Биологическое значение экзонуклеазных активностей полимераз.
Основные моменты:
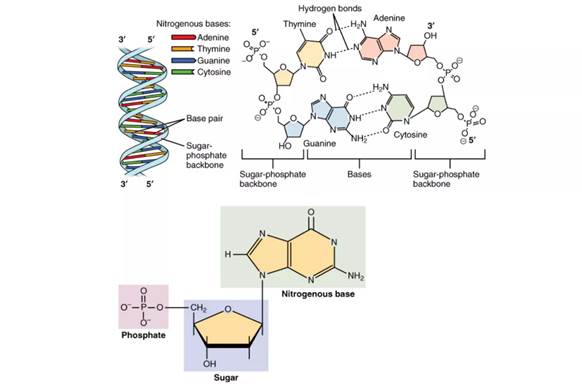
- НК включают ДНК и РНК, составленных нуклеотидами
- нуклеотид состоит из азотистого основания, пятиуглеродного сахара и фосфатной группы
- Основа ДНК - это пятиуглеродный сахар дезоксирибоза и азотистые основания аденин, гуанин, цитозин и тимин
- РНК имеет те же самые основания, только вместо тимина у нее предствлен урацил
Предшественники синтеза НК:
1. Пиримидины (аденин и гуанин):
В формировании кольца участвуют: аспарагин, глицин, глутамин, углекислый газ и два одноуглеродных производных тетрагидрофолата: метенил-Н4-фолат и формил-Н4-фолат
Чуть конкретнее по интермедиатам:
- рибозо-6-фосфат как основа
- 5-фосфорибозил-1-дифосфат
- 5-фосфорибозил-1-амин (фермент амидофосфорибозилтрансфераза)
- инозин-5штрих-монофосфат
- далее используется на синтез АМФ или ГМФ
2. Пурины (цитозин, тимин, урацил)
В формирование гетероциклического основания участвуют: глутамин, углекислый газ, аспарагиновая кислота
Конкретнее по интермедиатам:
- карбамоилфосфат из представленных выше веществ
- взаимодействие с аспартатом с образованием карбамоиласпартата
- отщепление воды с образованием дигидрооротат (циклический продукт)
- дегидрирование НАД-зависимой дигидрооротатдегидрогеназой с превращением в оротовую кислоту, или оротат - свободное пиримидиновое основание
- перенос фосфорибозильного остатка на оротат с образованием оротидин-5штрих-монофосфата
- декарбоксилирование последнего дает уридин-5штрих-фосфат
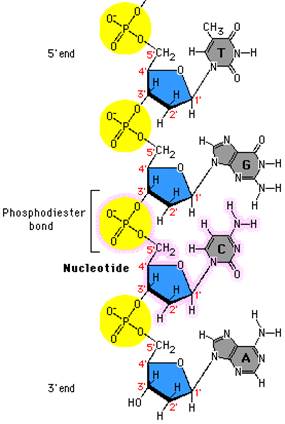
Как можно заметить, 5штрих-конец называется так потому, что фосфат присоединен к пятому атому рибозы. На 3штрих-конце выступает гидроксил, который отходит от третьего атома углерода рибозы.
Существуют 4 уровня структурной организации нуклеиновых кислот: первичная, вторичная, третичная и четвертичная. Первичная структура представляет собой цепочки из нуклеотидов, соединяющихся через остаток фосфорной кислоты (фосфодиэфирная связь). Вторичная структура — это две цепи нуклеиновых кислот соединённые водородными связями. Стоит отметить, что цепи соединяются по типу «голова-хвост» (3' к 5'), по принципу комплементарности (азотистые основания находятся внутри этой структуры). Третичная структура, или же спираль, образуется за счет радикалов азотистых оснований (образуются водородные дополнительные связи, которые и сворачивают эту структуру, тем самым обуславливая её прочность). И наконец 4 структура — это комплексы гистонов и нитей хроматина. (ВИКИ)
Рассмотрим последний уровень компактизации поподробнее.
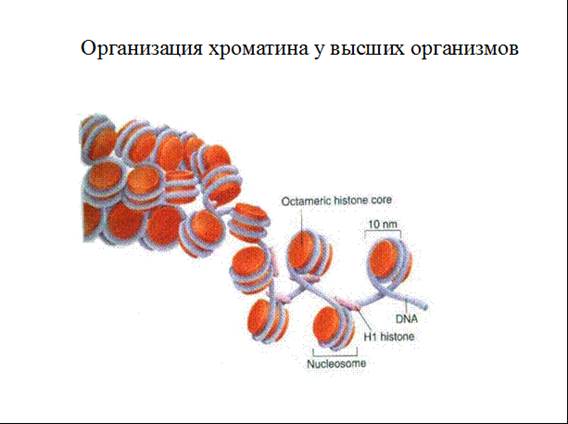
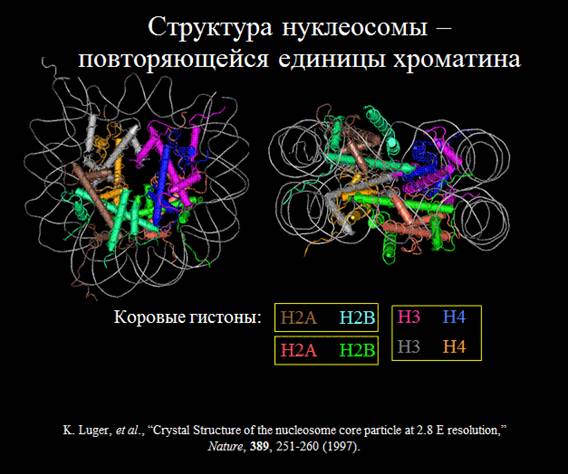
В данном случае нас интересует нуклеосомный уровень организации ДНК.
Основной повторяющейся единицей хроматина является нуклеосома, образованная 147 парами оснований ДНК, закрученными вокруг октамера, образованного коровыми гистонами H2A, H2B, H3 и H4. Эти так называемые канонические гистоны включаются в хроматин исключительно в S-фазе, их экспрессия регулируется клеточным циклом и они транскрибируются с нескольких генов, обычно распределенных в кластеры. Гистон Н1 взаимодействует с концами линкерной ДНК в районе тетрамера Н3-Н4.
Для всех гистонов, кроме H4, показано существование альтернативных вариантных гистонов, которые, в некоторых случаях, могут заменять канонические гистоны в составе нуклеосом. Вариантные формы гистонов – это белки, структура которых в основном совпадает со структурой гистона, но свойства несколько изменены из-за того, что по некоторым функциональным доменам происходят аминокислотные замены.
Дальнейшая упаковка хроматина достигается за счет взаимодействия ДНК с негистоновыми белками. Однако, именно нуклеосома играет центральную роль в упаковке ДНК на всех уровнях. Межнуклеосомные взаимодействия определяют степень компактизации ДНК, что соответственно облегчает или затрудняет доступ к ДНК многочисленным регуляторным факторам.
Репликация ДНК у прокариот и эукариот
Репликация является двунаправленной и начинается с точки Origin репликации (OriC) и продолжается до тех пор, пока весь репликон не будет дуплеципрован.
Процесс репликации состоит из трех этапов: инициация, элонгация и терминация.
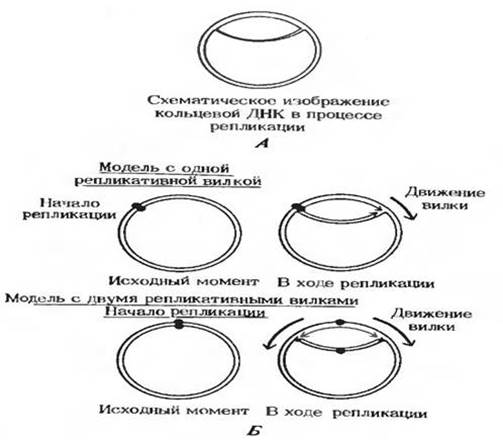
ДНК бактерий и многих ДНК-содержащих вирусов представляет собой кольцевую двойную спираль. Эксперименты, выполненные Д. Кэрнсом, показали, что ДНК в клетках E.coli реплицируется, оставаясь в кольцевой форме. Первоначально считали, что репликация начинается в фиксированной точке родительской ДНК (точке начала репликации) и что единственная репликативная вилка движется по кольцевой молекуле ДНК в одном направлении.
Однако последующие эксперименты, проведенные на хромосомах E.coli и вирусов, показали, что репликация обычно происходит в двух направлениях, т.е. существует две репликативные вилки. Обе вилки возникают в одной точке и удаляются от нее в обоих направлениях одновременно, пока снова не встретятся. В этой точке два полностью синтезированных дочерних двухцепочечных кольца разделяются: каждое из них содержит одну старую и одну новую цепь.
Участок начала репликации представляет собой нуклеотидную последовательность длиной 100-200 пар оснований. Эта последовательность узнается специфическими клеточными белками, которые начинают в этом месте цикл репликации.
В хронологическом порядке события репликации развертываются примерно следующим образом:
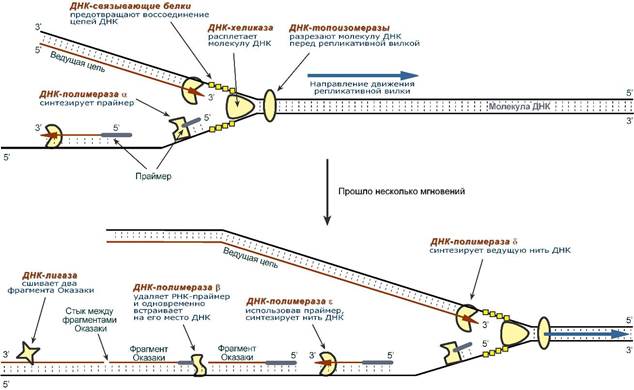
1. ДНК-топоизомеразы, находясь перед репликативной вилкой, разрезают молекулу ДНК для облегчения ее расплетания и раскручивания.
2. ДНК-хеликазы, следуя за топоизомеразами, раскручивают и расплетают молекулу ДНК.
3. ДНК-связывающие белки (ДСБ) связывают расплетенные нити ДНК и стабилизируют их, не допуская обратного "слипания" друг с другом.
4. ДНК-полимераза δ (греч.: δ – дельта), согласовано со скоростью движения репликативной вилки, осуществляет синтез ведущей цепи дочерней ДНК в направлении 5'→3' на матрице материнской нити ДНК по направлению от ее 3'-конца к 5'-концу (скорость до 100 пар нуклеотидов в секунду).
Этим события на данной материнской нити ДНК ограничиваются.
Далее описан синтез отстающей цепи дочерней ДНК.
5. Непосредственно сразу после расплетания и стабилизации другой нити материнской молекулы к ней присоединяется ДНК-полимераза α (α- альфа) и в направлении 5'→3' синтезирует праймер (РНК-затравку) – последовательность РНК на матрице ДНК длиной от 10 до 200 нуклеотидов. После этого фермент удаляется с нити ДНК.
Вместо ДНК-полимеразы α к 3'-концу праймера присоединяется ДНК-полимераза ε.
6. ДНК-полимераза ε (греч.: ε – эпсилон) как бы продолжает удлинять праймер, но в качестве субстрата встраивает дезоксирибонуклеотиды (в количестве 150-200 нуклеотидов). В результате образуется цельная нить из двух частей – РНК (т.е. праймер) и ДНК. ДНК-полимераза ε работает до тех пор, пока не встретит праймер предыдущего фрагмента Оказаки (синтезированный чуть ранее). После этого данный фермент удаляется с цепи.
7. ДНК-полимераза β (греч.: β – бета) встает вместо ДНК-полимеразы ε, движется в том же направлении (5'→3') и удаляет рибонуклеотиды праймера, одновременно встраивая дезоксирибонуклеотиды на их место. Фермент работает до полного удаления праймера, т.е. пока на его пути не встанет дезоксирибонуклеотид (еще более ранее синтезированный ДНК-полимеразой ε). Связать результат свой работы и впереди стоящую ДНК фермент не в состоянии, поэтому он сходит с цепи.
В результате на матрице материнской нити "лежит" фрагмент дочерней ДНК. Он называется фрагмент Оказаки.
8. ДНК-лигаза производит сшивку двух соседних фрагментов Оказаки, т.е. 5'-конца отрезка, синтезированного ДНК-полимеразой ε, и 3'-конца цепи, встроенного ДНК-полимеразой β.
ДНК-полимеразы не могут начинать синтез ДНК непосредственно на матрице, а способны только добавлять новые дезоксирибонуклеотидные звенья к 3'-концу уже имеющейся полинуклеотидной цепи. Такую заранее образованную цепь, к которой добавляются нуклеотиды, называют праймером (или затравкой), она состоит из РНК. Короткую РНК-затравку синтезирует из рибонуклеозидтрифосфатов фермент, называемый ДНК-праймазой. Праймазная активность может принадлежать либо отдельному ферменту, либо одной из субъединиц ДНК-полимеразы. Праймаза связывается с геликазой и ДНК, формируя структуру, называемую праймосомой, и синтезирует РНК-праймер. РНК-праймеры удлиняются действием ДНК-полимеразы III у прокарит и ДНК-полимеразой α у эукариот. (Спивак, 2011)
(из неизвестного учебника)
Этапы репликации у прокариот.
Синтез ДНК у прокариот осуществляют ДНК-полимеразы:
- ДНК-полимераза I, которая участвует в репликации и репарации;
- ДНК-полимераза II – вероятно, участвует в репарации;
- ДНК-полимераза III – основной фермент репликации.
Инициация репликации. Репликация начинается с расплетения двойной спирали ДНК и образования репликативной вилки. Это осуществляется при помощи ферментов хеликаз, которые перемещаются вдоль цепей ДНК и раскручивают их. Процесс расплетения двойной спирали ДНК является энергозависимым и требует затраты АТФ. Далее SSB-белки (single strand binding) специфично связываются с одноцепочечной ДНК и препятствуют образованию двойных спиралей (ренатурации ДНК) и шпилечных структур.
Интенсивное раскручивание ДНК может приводить к образованию дополнительных супервитков, которые «снимают» топоизомераты (гираза).
Праймаза комплементарно из рибонуклеозидтрифосфатов синтезирует на матрице ДНК праймер, или РНК-затравку – короткий фрагмент РНК (10-12 нуклеотидов), 3’-ОН-конец которого используется для дальнейшего синтеза ДНК ключевым ферментом репликации ДНК у прокариот - ДНК-полимеразой III.
Элонгация репликации. Субстратами для синтеза дочерних цепей являются четыре дезоксинуклеозидтрифосфата (дНТФ): дАТФ, дТТФ, дЦТФ, дГТФ. С 3’-ОН-конца праймера ДНК-полимераза III начинает синтезировать новую цепь ДНК присоединением каждого последующего дНТФ только к 3’-ОН-концу имеющейся цепи с выделением пирофосфата:
НТФ + (НМФ)n → (НМФ)n+1 + ФФН
Синтез дочерних цепей ДНК идет в направлении 5’→3’ одновременно на обеих цепях матрицы ДНК.
Однако, так как цепи ДНК антипараллельны, а ДНК-полимеразы синтезируют ДНКприсоединением каждого последующего нуклеотида только к 3’-концу имеющейся цепи, в 1960-х гг. Рейжи Оказаки экспериментально доказал, что синтез одной цепи ДНК происходит фрагментарно, прерывисто. Эти фрагменты были названы фрагментами Оказаки.
Т.о. синтез одной цепи происходит непрерывно от 5’- к 3’-концу в направлении движения репликативной вилки и необходим только 1 акт инициации и один праймер. Эта цепь называется лидирующей.
Синтез второй цепи ДНК, которая называется отстающей, также происходит от 5’- к 3’- концу, но в противоположном направлении репликативной вилки, инициируется многократно, т.о. синтезируется много праймеров и фрагментов Оказаки. У прокариот фрагменты Оказаки имеют длину около 1000 нуклеотидов, у эукариот – 150-300 нуклеотидов.
ДНК-полимераза III синтезирует цепь ДНК до следующей затравки. Далее ДНК-полимераза I удаляет праймер с 5’-конца и одновременно замещая рибонуклеотиды дезоксирибонуклеотидами, а ДНК-лигаза сшивает фрагменты Оказаки в непрерывную цепь.
При включении неправильного нуклеотида ДНК-полимеразы I и III удаляют ошибочный нуклеотид с 3’-конца, гидролизуя фосфодиэфирную связь.
В результате образуются дочерние цепи, комплементарные и антипараллельные цепям материнской ДНК.
Фермент ДНК-лигаза катализирует образование фосфодиэфирной связи между 3'-ОН-группой дезоксирибозы одного фрагмента цепи ДНК и 5'-фосфатом следующего фрагмента. Реакция протекает с затратой энергии АТФ. Таким образом, из множества фрагментов Оказаки образуется непрерывная цепь ДНК.
ДНК-полимеразы
ДНК-полимераза — фермент, участвующий в репликации ДНК. Ферменты этого класса катализируют полимеризацию дезоксирибонуклеотидов вдоль цепочки нуклеотидов ДНК, которую фермент «читает» и использует в качестве шаблона. Тип нового нуклеотида определяется по принципу комплементарности с шаблоном, с которого ведётся считывание. Собираемая молекула комплементарна шаблонной моноспирали и идентична второму компоненту двойной спирали.
Действие ДНК-полимераз
Как известно, две цепи молекулы ДНК антипараллельны. Разные концы одной цепи называются 3’-конец и 5’-конец. Репликация происходит путём непрерывного роста нуклеотида за нуклеотидом обеих новых цепей одновременно. Матрица считывается ДНК-полимеразой только в направлении 3’-5’, добавляя свободные нуклеотиды к 3’-концу собираемой цепочки. Поэтому синтез ДНК происходит непрерывно только на одной из матричных цепей, называемой «лидирующей». Во второй цепи («отстающей») синтез происходит короткими фрагментами.
Ни одна из известных ДНК-полимераз не может создать цепочку «с нуля»: они в состоянии лишь добавлять нуклеотиды к уже существующей 3’-гидроксильной группе. По этой причине ДНК-полимераза нуждается в праймере, к которому она могла бы добавить первый нуклеотид. Праймеры состоят из оснований РНК и ДНК, при этом первые два основания всегда РНК-основания. Праймеры синтезируются другим ферментом — праймазой. Ещё один фермент — хеликаза — необходим для раскручивания двойной спирали ДНК с формированием одноцепочечной структуры, которая обеспечивает репликацию обеих цепочек в соответствии с полуконсервативной моделью репликации ДНК.
Некоторые ДНК-полимеразы обладают также способностью исправлять ошибки во вновь собираемой цепочке ДНК. Если происходит обнаружение неправильной пары нуклеотидов, ДНК-полимераза откатывается на один шаг назад. Благодаря своей 3'-5'-экзонуклеазной гидролитической активности ДНК-полимераза может исключить неправильный нуклеотид из цепочки и затем вставить на его место правильный, после чего репликация продолжается в нормальном режиме.
---
Оптимальные условия для культивирования клеток млекопитающих: каким образом они обеспечиваются? Самая распространённая питательная среда для культивирования клеток млекопитающих: основные компоненты. Для чего в питательную среду добавляют сыворотку крови эмбрионов коров? Для чего в среду добавлен краситель? Посуда для культивирования клеток. Подготовка посуды и приборов для использования их в работе с клетками эукариот. Каким образом обеспечивается асептичная среда при культивировании клеток эукариот? Устройство ламинарного бокса. Типы клеточных культур. Каким образом клетки могут быть откреплены от субстрата, на котором находятся, для пересева в другую посуду?
Культивирование клеток
Клетки выращивают в специальных питательных средах, при постоянной температуре. Для культур растительных клеток используется регулируемое освещение, а для клеток млекопитающих обычно необходима также специальная газовая среда, поддерживаемая в инкубаторе клеточных культур. Как правило, регулируется концентрация в воздухе углекислого газа и паров воды, но иногда также и кислорода. Питательные среды для разных культур клеток различаются по составу, pH, концентрации глюкозы, составу факторов роста и др. Факторы роста, используемые в питательных средах для клеток млекопитающих, чаще всего добавляют вместе с сывороткой крови. Одним из факторов риска при этом является возможность заражения культуры клеток прионами или вирусами. При культивировании одной из важных задач является исключение или сведение к минимуму использование заражённых ингредиентов. Однако на практике это бывает достигнуто не всегда. Наилучшим, но и наиболее дорогостоящим способом является добавление вместо сыворотки очищенных факторов роста.
Клетки можно выращивать в суспензии, либо в адгезивном состоянии. Некоторые клетки (такие, как клетки крови) в естественных условиях существуют во взвешенном состоянии. Существуют также линии клеток, искусственно изменённых таким образом, чтобы они не могли прикрепляться к поверхности; это сделано для того, чтобы увеличить плотность клеток в культуре. Для выращивания адгезивных клеток требуется поверхность, например, культура ткани, или пластик, покрытый элементами внеклеточного матрикса для улучшения адгезивных свойств, а также для стимулирования роста и дифференцировки. Большинство клеток из мягких и твердых тканей адгезивны. Из адгезивного типа культуры выделяются органотипические культуры клеток, которые представляют собой трёхмерную среду, в отличие от обычной лабораторной посуды.
Наиболее распространенные питательные среды для культивирования клеток млекопитающих:
- для клеток глиобластомы: DMEM (с L-глюкозой), ФБС, антибиотик-антимикотик (соотношение 89:10:1)
- для фибробластов: DMEM (возможно с высоким содержанием глюкозы), 10% фетальная бычья сыворотка, L-глутамин или Глутамакс.
Фетальная бычья сыворотка (ФБС) поступает из крови, отобранной из бычьего плода с помощью замкнутой системы сбора на бойне. ФБС является наиболее широко используемой добавкой для ин витро культуры клеток эукариот. Это связано с очень низким уровнем антител и высоким содержанием факторов роста.
"Шаровые" белки, или бычий сывороточный альбумин (БС), являются одним из основных компонентов сыворотки плода коровы. Богатое разнообразие белков в эмбриональной бычьей сыворотки поддерживает культивируемые в среде клетки, в которой они могут выживать, расти и делиться.
Краситель в среду добавяется для индикации того момента, когда в среде появится достаточно много метаболитов, произведенных клетками.
Основные виды культуральной посуды для работы с клеточными культурами:
- чашки Петри
- культуральные флаконы, или фласки
- многогнездовые планшеты
Асептическая среда при работе с культурами клеток в ламнарном боксе обеспечивается следующими процедурами:
- обработка спиртовым раствором 96% крепости всего вносимого в бокс, в том числе конечностей
- не исключено внесение рабочего инструмента в пламя горящей внутри бокс спиртовки
- многие пластмассовые изделия, в том числе носики дозаторов, упаковываются в специальные коробки, которые запечатываются фольгой, после чего автоклавируются
- рабочую поверхность бокса подвергают воздействию УВ-света до и после работы в течение обычно 20 минут
Принципиальная часть ламинарного бокса - это зона, в которой имеет место ламинарный поток.
Ламинарные воздушные потоки защищают рабочую зону от загрязнения частицами, находящимися в окружающем воздухе. Многим медицинским и исследовательским лабораториям требуется стерильная рабочая среда для проведения специализированных работ. Одним из самых распространенных решений для организации стерильного пространства являются ламинарные боксы (ламинары, ламинарные шкафы).
Как уже было упомянуто выше, культура клеток млекопитающих может быть адгезивной (глиобластома, фибробласты) и в виде суспензии (эритроциты).
Основной способ открепления клеток от поверхности культурной среды - это добавление в среду раствора трипсина. После этого культуральный флакон помещается в инкубатор на заданное время, и уже после этого клетки готовы к пересадке.
---
5. Устройство генетического аппарата прокариот и эукариот. Понятие гена, промотора, оперона. Какие типы ДНК и РНК есть в клетках прокариот и эукариот? Состав среды для роста культур бактерий. Стандартная среда для выращивания культур Escherichia coli. Какой их компонентов является источником пептидов, витаминов, макро- и микроэлементов, ионов, обеспечивающих осмотический баланс?
Ген - это совокупность генетических последовательностей, кодирующих сцепленный набор потенциально перекрывающихся функциональных продуктов.
Промотор (англ. promoter) — последовательность нуклеотидов ДНК, узнаваемая РНК-полимеразой как стартовая площадка для начала транскрипции. Промотор играет одну из ключевых ролей в процессе инициации транскрипции.
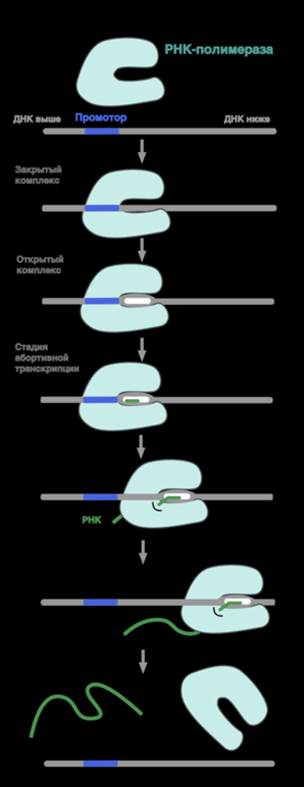
Обычно промотор расположен вокруг точки старта транскрипции – первого нуклеотида, с которого получается транскрипт, имеющий координату +1 (предыдущий нуклеотид обозначается как -1). Промотор обычно включает ряд мотивов, важных для узнавания его РНК-полимеразой. В частности, -10 и -35 элементы у бактерий, ТАТА-бокс у эукариот.
То, под каким промотором находится кодирующий РНК участок ДНК, играет решающую роль в интенсивности экспрессии этого гена в каждом конкретном типе клеток. По активности промоторы делят на конститутивные (постоянный уровень транскрипции) и индуцибельные (транскрипция зависит от условий в клетке, например от присутствия определенных веществ или наличия теплового шока). Активация промотора определяется присутствием набора транскрипционных факторов.
Теория оперона
(механизмы регуляции работы генов у эукариот)
Лактозный оперон
Лактозный оперон в целом отвечает за катаболизм лактозы.
При изучении E.coli было замечено, что в клетке может быть две взаимоисключающие ситуации:
- активность одного из ферментов катаболизма лактозы низка, если в среде имеется много глюкозы.
- активность этого же фермента резко повышается в обратной ситуации, т.е. при отсутствии глюкозы и при наличии лактозы.
На основании наблюдений была предложена схема регуляции оперона по механизму индукции:
1. При отсутствии лактозы активный белок-репрессор связывается с оператором и блокирует синтез мРНК, кодирующей ферменты катаболизма лактозы. В результате эти ферменты не образуются.
2. Если глюкозы нет, а лактоза есть, то последняя связывается с белком-репрессором и ингибирует его, не давая ему связаться с геном-оператором и препятствовать работе РНК-полимеразы. Это позволяет РНК-полимеразе считывать информацию, отвечающую за синтез ферментов катаболизма лактозы, и синтезировать мРНК.
Таким образом, лактоза является индуктором транскрипции.

Триптофановый оперон
Триптофановый оперон в целом отвечает за синтез триптофана.
Функционирование триптофанового оперона в некотором смысле противоположно лактозному. Регуляция осуществляется по механизму репрессии.
1. В отличие от лактозного оперона, белок-репрессор синтезируется в неактивном состоянии и не может заблокировать транскрипцию генов, кодирующих ферменты синтеза триптофана. Синтез этой аминокислоты будет в клетке продолжаться до тех пор, пока в питательной среде не появится триптофан.
2. Триптофан соединяется с белком-репрессором и активирует его. Далее такой активный комплекс присоединяется к гену-оператору и блокирует транскрипцию. Таким образом, при наличии триптофана в среде прекращается его внутриклеточный синтез, экономятся ресурсы и энергия бактериальной клетки.
В этом случае триптофан является репрессором транскрипции.

У эукариот ДНК находится в хромосомах. В клетках человека 46 хромосом (хроматид), которые организованы в 23 пары. Каждая хромосома эукариотической клетки содержит одну очень большую молекулу двухцепочечной ДНК, несущую набор генов. Совокупность генов клетки составляет ее геном. Гены – это участки ДНК, которые кодируют полипептидные цепи и РНК.
Молекулы ДНК в 46 хромосомах человека не одинаковы по размеру. Средняя длина хромосомы составляет 130 млн. пар оснований и имеет длину 5 см. Понятно, что уместить такую ДНК в ядре возможно только путем ее определенной упаковки. При образовании третичной структуры ДНК человека происходит в среднем уменьшение ее размеров в 100 тысяч раз.
Упаковка ДНК в эукариотических хромосомах отличается от ее упаковки в прокариотических хромосомах. Эукариотические ДНК имеют не кольцевую, а линейную двухцепочечную структуру. Кроме того, третичная структура ДНК у эукариотических клеток отличается тем, что многократная спирализация ДНК сопровождается образованием комплексов с белками. ДНК эукариот содержит экзоны - участки, кодирующие полипептидные цепи, и интроны – некодирующие участки (выполняют регуляторную функцию).
У прокариот молекула ДНК уложена в виде петли, комплексируется некоторыми гистоновыми белками, образуя нуклеоид. Основная масса ДНК (95 %) активно транскрибируется в каждый данный момент времени.
РНК у эукариот:
- мРНК — РНК, содержащая информацию о первичной структуре (аминокислотной последовательности) белков. мРНК синтезируется на основе ДНК в ходе транскрипции, после чего, в свою очередь, используется в ходе трансляции как матрица для синтеза белков. Тем самым мРНК играет важную роль в «проявлении» (экспрессии) генов
- тРНК - рибонуклеиновая кислота, обеспечивающая взаимодействие аминокислоты, рибосомы и матричной РНК (мРНК) в ходе трансляции. Имеет типичную длину от 73 до 93 нуклеотидов и размеры около 5 нм. тРНК, будучи ковалентно связаны с остатком аминокислоты, принимает непосредственное участие в наращивании полипептидной цепи, специфически присоединяясь к кодону мРНК и обеспечивая необходимую для образования новой пептидной связи конформацию комплекса
- рРНК - несколько молекул РНК, составляющих основу рибосомы. Основным назначением рРНК является осуществление трансляции — считывания информации с мРНК при помощи адапторных молекул тРНК и катализ образования пептидных связей между присоединёнными к тРНК аминокислотами
- миРНК - малые некодирующие молекулы РНК длиной 18—25 нуклеотидов (в среднем 22), обнаруженные у растений, животных и некоторых вирусов, принимающие участие в транскрипционной и посттранскипционной регуляции экспрессии генов путём РНК-интерференции. Помимо внутриклеточной обнаружена внеклеточная (циркулирующая) микроРНК
РНК бактерий:
- тмРНК - (транспортно-матричные) небольшая РНК длиной от 260 до 430 нуклеотидов, которая участвует в высвобождении рибосом, «застрявших» во время трансляции проблемных участков мРНК, а также разрушении получившихся в ходе неполной трансляции дефектных пептидов. Механизм высвобождения рибосомы с дефектной мРНК при участии тмРНК получил название транс-трансляции. Первая тмРНК была обнаружена в 1994 году[2] у кишечной палочки Escherichia coli, и с тех пор тмРНК были описаны у разных групп бактерий
-
Питательные среды — это субстраты, используемые для культивирования в искусственных условиях различных микроорганизмов.
По происхождению среды разделяют на искусственные и естественные (природные).
Естественные среды. Готовятся такие смеси из природных компонентов. Это может быть речная вода, части растений, навоз, овощи, растительные и животные ткани, дрожжи и т. д. Такие среды характеризуются высоким содержанием природных химических веществ, многообразие которых способствует росту культуры бактерий. Несмотря на такие очевидные преимущества, естественные среды не позволяют вести специализированные исследования с конкретными штаммами бактерий.
Синтетические среды. Они отличаются тем, что их химический состав известен в точных соотношениях всех составляющих. Такие среды готовятся для определенной культуры бактерий, метаболизм которой заранее известен исследователю. Собственно, по этой причине возможно приготовить подобную синтетическую среду для развития микроорганизмов. Применяются они для анализа жизнедеятельности бактерий. Например, можно узнать, какие вещества они выделяют в окружающую среду и сколько. На естественных средах микроорганизмы также будут расти, но отслеживать какие-то количественные изменения в составе невозможно из-за незнания изначальных пропорций веществ.
По составу питательные среды делятся на простые и сложные.
Различают группу сред общего назначения - простых. К этой группе относят мясо-пептонный бульон (простой питательный бульон), мясо-пептонный агар {простой питательный агар), питательный желатин. Эти среды применяются для выращивания многих патогенных микробов. Среды общего назначения, или простые питательные среды, готовятся обычно из гидролизатов с добавлением пептона и хлористого натрия. Их используют также как основу для приготовления сложных сред.
Также по составу выделяют белковые, безбелковые и минеральные среды. Бактерии могут выращиваться не только на твердых субстратах. Среды питательные отличаются между собой по агрегатному состоянию, что зависит от состава при изготовлении. Изначально все они имеют жидкую консистенцию, а при добавлении желатина или агара в определенном процентном соотношении смесь застывает. Жидкие питательные среды обычно находятся в пробирках. Если появляется необходимость выращивать бактерии в таких условиях, добавляют раствор с пробой культуры и ждут 2-3 суток. Результат может быть различным: выпадает осадок, появляется пленка, плавают мелкие хлопья или образуется мутный раствор. Плотная питательная среда часто используется в микробиологическом исследовании для изучения свойств колоний бактерий. Такие среды всегда прозрачные или полупрозрачные, чтобы была возможность правильно определить цвет и форму культуры микроорганизмов.
По целевому назначении питательные среды делят на основные, элективные и дифференциально-диагностические. К основным относятся среды, применяемые для выращивания многих бактерий. По составу принято выделять естественные или натуральные среды неопределенного состава и синтетические среды, о которых уже говорилось выше. К основным средам, используемым в микробиологии, относят триптические гидролизаты казеина, рыбных продуктов, мясокостной муки и др., из которых готовят жидкую среду - питательный бульон и плотную - питательный агар. Такие среды служат основой для приготовления более сложных: сахарных, кровяных, сывороточных и др., удовлетворяющих пищевой потребности более требовательных патогенных бактерий.
Элективные питательные среды предназначены для избирательного выделения и накопления микроорганизмов определенного вида в местах их естественного обитания из материалов, содержащих разнообразную постороннюю микрофлору. Создавая элективные (для определенных микробов) питательные среды, исходят из биологических особенностей, которые, отличают данные микроорганизмы от большинства других. Например, избирательный рост стафилококка наблюдается при повышенной концентрации хлорида натрия, холерного вибриона - в щелочной среде. Элективные питательные среды содержат дополнительные вещества, задерживающие рост грамположительных бактерий. Селективные питательные среды стимулируют рост одних микробов и угнетают рост других. Селективные условия получают путем добавления в среду химических веществ. Так как в этих средах патогенные бактерии размножаются и накапливаются, их называют также средами обогащения.
Дифференциально-диагностические питательные среды применяются для разграничения отдельных видов или групп микроорганизмов. Принцип построения дифференциально-диагностических сред основан на том, что равные виды бактерий различаются между собой по биохимической активности и имеют неодинаковый набор ферментов, расщепляющих субстраты, входящие в состав питательной среды. Компонентами дифференциально-диагностических сред являются:
а) основная питательная среда, обеспечивающая размножение бактерий;
б) определенный химический субстрат (например, лактоза в среде Эндо), различное отношение к которому является диагностическим признаком для микроорганизмов; в цветной индикатор (например, индикатор Андреде), изменение цвета которого свидетельствует о биохимической реакции и наличии данной ферментной системы у исследуемого микроорганизма. Дифференциально-диагностические среды широко используются в диагностических исследованиях для идентификации бактерий. По своему назначению дифференциально-диагностические среды разделяют следующим образом:
1. Среды для выявления протеолитической способности микробов, содержащие в своем составе молоко, желатин, кровь и т.д.
2. Среды с углеводами и многоатомными спиртами для обнаружения различных сахаролитических ферментов.
В состав дифференциально-диагностических сред, предназначенных для выявления сахаролитических свойств и окислительно-восстановительных ферментов, вводят индикаторы: нейтральную красную, кислый фуксин, бромтимоловый синий, водный голубой с розоловой кислотой (ВР). Изменяя свою окраску при различных значениях рН, индикатор указывает на наличие фермента и расщепление введённого в среду ингредиента.
По назначению выделяют консервирующие среды (для первичного посева и транспортировки), среды обогащения (для накопления определённой группы бактерий), среды для культивирования {универсальные простые, сложные специальные и для токсинообразования), среды для выделения и накопления (консервирующие, обогащения и элективные) и среды для идентификации (дифференциальные и элективно-дифференциальные).
Консервирующие питательные среды предупреждают отмирание патогенов и подавляют рост сапрофитов. Наибольшее применение нашли глицериновая смесь, гипертонический раствор, глицериновый консервант с LiCl2, раствор цитрата натрия и дезоксихолата натрия.
Среды обогащения для бактерий
Среды обогащения (например, среда Китта-Тароцци, селенитовый бульон, тиогликолевая среда) применяют для накопления определённой группы бактерий за счёт создания условий, оптимальных для одних видов и неблагоприятных для других. Наиболее часто в качестве подобных агентов используют различные красители и химические вещества — соли жёлчных кислот, тетратионат Na+, теллурит К, антибиотики, фуксин, генциановый фиолетовый, бриллиантовый зелёный и др.
По назначению питательные среды подразделяют на следующие основные категории.
Универсальные — среды, на которых хорошо растут многие виды патогенных и непатогенных бактерий. К ним относятся: мясо-пептонный бульон (МПБ = мясная вода + 1% пептона + 0,5% NaCl), мясо-пептонный агар (МПА = МПБ + 2-3% агара).
Дифференциально-диагностические — среды, позволяющие отличать одни виды бактерий от других по их ферментативной активности или культуральным проявлениям. К ним относятся среды Эндо, Левина, Плоскирева, Гисса и многие др.
Селективные (синонимы: избирательные, элективные, обогатительные) — среды, содержащие вещества, используемые микроорганизмами определенных видов и не благоприятствующие или даже препятствующие росту других микроорганизмов. Селективные среды позволяют направленно отбирать из исследуемого материала определенные виды бактерий. Сюда относятся среды Мюллера, селенитовая, Рапопорт, 1%-ная пептонная вода и др.
Дифференциально-селективные — среды, сочетающие в себе свойства дифференциально-диагностических и селективных сред. Они используются, в частности, для ускорения обнаружения и идентификации бактерий, относящихся к большому числу широко распространенных видов энтеробактерий и псевдомонад (среды Сиволодского). Среда Эндо
Специальные — среды, специально приготовленные для получения роста тех бактерий, которые не растут или очень плохо растут на универсальных средах. К ним относятся среды Мак-Коя-Чепина (для получения роста возбудителя туляремии), кровяной МПА (для получения роста патогенных стрептококков), среда Левенштейна-Иенсена (для выделения возбудителя туберкулеза) и др.
Синтетические — среды строго определенного химического состава, представляющие собой растворы неорганических солей с добавлением химических соединений, которые служат источником углерода или азота. Примером такой синтетической среды является минимальная среда М-9, в которой источником энергии и углерода является глюкоза, а азота — NH4C1. Синтетические среды могут быть и более сложного состава с включением различных аминокислот, оснований и витаминов.
Полусинтетические — синтетические среды, к которым добавляют какой-либо продукт природного происхождения, например сыворотку крови. Существует много различных вариантов питательных сред, сконструированных с учетом потребностей соответствующих видов бактерий и диагностических целей.
Требования, предъявляемые к питательным средам.
1. Питательные среды должны содержать необходимые для питания микробов питательные вещества.
2. Иметь реакцию рН, оптимальную для выращиваемого вида микроба. -
3. Питательные среды должны иметь достаточную влажность и вязкость, т.к. микробы питаются по законам диффузии и осмоса.
4. Обладать изотоничностью и иметь определенный окислительно-восстановительный потенциал (гН2).
5. Питательные среды должны быть стерильными, обеспечивая тем самым возможность выращивания чистых культур.
Потребность в питательных веществах и физических условиях у различных видов микробов неодинакова, и этим исключается возможность создания универсальной питательной среды.
Реакция среды. Для роста разных видов микробов требуется определенная реакция среды, которая выражается показателем концентрации водородных ионов (рН). Для большинства бактерий устанавливают рН среды в пределах 6.8-8.0. Ориентировочную реакцию питательной среды можно устанавливать стандартной индикаторной бумагой. Чаще всего для ее изготовления используют индикатор крезоловый красный. Для более точного измерения среды используют рН-метр.
Для успешного роста микробов недостаточно правильно установить первоначальную реакцию питательной среды. Микроорганизмы в процессе роста образуют ряд кислот, что делает реакцию среды кислой и является основной причиной прекращения роста. Во избежание этого необходимо создать условия, препятствующие резкому изменению реакции среды. Отчасти препятствуют изменению рН азотистые вещества, имеющиеся в среде. Чем больше аминокислот в субстрате, тем большими буферными свойствами обладает среда. В настоящее время ко многим питательным смесям прибавляют еще фосфатные буферные смеси.
Индикаторы, меняющие свай цвет при изменении рН среды, используют не только для определения реакции среды. Их вводят также в состав специальных сред, которые служат для выявления биохимических свойств микробов. Изменение цвета среды указывает на образование кислоты или щелочи при ферментативной деятельности микробов. Известны индикаторы, приобретающие ту или иную окраску лишь при щелочной или кислой реакции, вне этой реакции они бесцветны. Так, среда, содержащая индикатор Андреде меняет свою интенсивную красную окраску при значениях рН=5.3-5.5, в случае подщелачивания среды, становится бесцветной - при рН=7.2. Фенолфталеин бесцветен при кислой реакции, а окраску приобретет з диапазоне рН=8.3-10.0.
Более удобны двухцветные индикаторы, имеющие разную окраску в кислой и щелочной среде. Наиболее широко распространены индикаторы Кларка. Они имеют различную окраску в кислой и щелочной среде. В средах, содержащих такие индикаторы, хорошо выражены переходные тона. Кроме того, диапазон чувствительности индикаторов Кларка весьма широк.
LB Media (Лурия-Бертрани) - это широкораспространенные среды для роста Escherichia Coli. Впервые были описаны в пятидесятых годах 20-го века.
Два главных компонента питательной среды - это триптон и дрожжевой экстракт. Триптон применяется в коцентрации 10 граммов/литр, а дрожжевой экстракт - 5 граммов на литр. Многие варианты LB Medium различаются только в концентрации хлорида натрия.
Вариант Miller содержит много соли - 10 гр/литр, в то время как вариант Lenox имеет низкое содержание соли со значением 5 гр/литр. L-broth содержит всего 0.5 гр хлорида натрия на литр, и используется в основном во время работы с фагом P1.
---
Проект «Геном человека», его лидеры и две конкурирующие группы. Результаты проекта: количество генов, доля белок-кодирующих последовательностей, уникальные последовательности, повторенные последовательности (повторы), их основные типы, мобильные генетические элементы, транспозоны и их типы. Транскрипция и экспрессия генов, принципы транскрипции, промоторы сильные и слабые, консенсусные последовательности и их основные мотивы у прокариот и эукариот. Единицы транскрипции, тандемно-повторенные гены, «ёлочки траскрипции», понятие ядрышкового организатора, понятие процессинга РНК, сплайсинга и альтернативного сплайсинга. Многообразие РНК и их функции: (mRNAs (мРНК/иРНК), rRNAs (рРНК), tRNAs (тРНК), snRNAs, snoRNAs, scaRNAs, miRNAs, siRNAs и др (теломеразная РНК, например). Сайленсинг, его принцип, участие РНК, и специфических белков.
Проект Человеческий Геном (англ. The Human Genome Project, HGP) — международный научно-исследовательский проект, главной целью которого было определить последовательность нуклеотидов, которые составляют ДНК.
(про историю в конце)
Всего было определено около 60 тысяч генов, но только 20-25 тысяч из них оказались белоккодирущими.
(отрывок с МедУнивер, основанный на статьях, которые укажу в самом низу)
Области генома с аналогичными характеристиками или организацией, репликацией и экспрессией не размещаются произвольно, а имеют тенденцию объединяться. Функциональная организация генома в высшей степени согласована со структурной организацией, что обнаруживают лабораторными методами хромосомного анализа. Общее значение функциональной организации — то, что хромосомы не просто случайный набор различных типов генов и других последовательностей ДНК. Некоторые хромосомные участки и даже целые хромосомы «богаты» генами, в то время как другие — относительно «бедны». Определенные типы нуклеотидных последовательностей характерны для различных структурных характеристик хромосом человека. Клинические последствия аномалий структуры генома отражают специфическую природу вовлеченных генов и последовательностей. Так, аномалии хромосом или хромосомных участков, содержащих много генов, имеют более серьезные клинические последствия, чем аналогичные по размеру дефекты, включающие «бедные» генами части генома. В ходе реализации проекта «Геном человека» стало ясно, что организация ДНК в человеческом геноме значительно более изменчива, чем считалось раньше. Из 3 млрд пар оснований ДНК в геноме менее чем 1,5% действительно кодируют белки и только около 5% потенциально содержат регу-ляторные элементы, которые могут как-то влиять или определять спектр экспрессии генов в ходе развития или в различных тканях. Только около половины общей протяженности генома состоит из так называемой однокопийной, или уникальной, ДНК, т.е. ДНК, нуклеотидная последовательность которой представлена однократно (или только несколько раз). Остальная часть генома состоит из нескольких классов повторяющейся ДНК и включает ДНК, нуклеотидная последовательность которой повторяется или полностью, или с некоторыми вариациями, от сотен до миллионов раз в геноме. Поскольку большинство (хотя и не все) из предполагаемых 25 000 генов в геноме представлены единственной копией, повторяющиеся части ДНК способствуют поддержанию хромосомной структуры и в значительной мере обеспечивают вариабельность между различными индивидуумами. Некоторые из таких вариантов могут предрасполагать к патологическим событиям в геноме.
Уникальные ДНК-последовательности генома человека Хотя уникальные ДНК-последовательности занимают по крайней мере половину генома, большинство их функций остается загадкой, поскольку, как уже сказано, последовательности, действительно кодирующие белки (т.е. кодирующие части генов), составляют только небольшую часть всей уникальной ДНК. Большинство уникальной ДНК обнаруживают в виде коротких участков (несколько килобаз и даже короче), перемежающихся с участками повторяющейся ДНК различных типов. Повторяющиеся ДНК-последовательности генома человека Найдено несколько различных категорий повторяющейся ДНК. Одно из отличий — то, что они («повторы») либо объединяются в одном или нескольких блоках (кластерах), либо распределены по геному, перемежаясь на хромосоме с уникальными последовательностями. Кластерные повторы составляют ориентировочно от 10 до 15% генома и состоят из большого числа различных тандемных повторов, последовательно стоящих в ДНК. Различные типы тандемных повторов объединяют в так называемую сателлитную (спутниковую) ДНК, поскольку многие семейства таких повторов могут быть выделены из общего генома биохимическими методами как специфические (спутниковые) фракции ДНК. Семейства тандемных повторов различаются своим положением в геноме, протяженностью всего массива и длиной отдельных повторов, входящих в массив. Часто такие массивы могут занимать несколько миллионов пар оснований и более и составлять вплоть до нескольких процентов ДНК отдельной хромосомы. Многие тандемные повторы важны как молекулярные инструменты, революционно изменившие клинический цитогенетический анализ, вследствие их относительно удобного обнаружения. Некоторые тандемные повторы образованы короткими последовательностями, например пятью нуклеотидами. Длинные массивы таких повторов обнаруживают в больших генетически инертных регионах в хромосомах 1, 9 и 16, а также они составляют более половины Y-хромосомы. Другие фракции тандемных повторов состоят из более длинных повторяющихся участков. Например, а-сателлитная фракция ДНК, состоящая из повторяющихся последовательностей длиной около 171 пары оснований, обнаружена в околоцентромерных участках хромосом, ответственных за присоединение хромосом к нитям веретена деления. Полагают, что это семейство повторов играет роль в функционировании центромеры, гарантируя расхождение хромосом в митозе и мейозе. Помимо тандемной, в геноме существует другой крупный класс повторяющейся ДНК, состоящий из родственных последовательностей, рассеянных по всему геному без четкой локализации. Хотя многие небольшие фракции ДНК соответствуют этому определению, мы обсудим только две из них, поскольку они занимают значимую часть генома и именно они вовлечены в развитие генетических болезней. Одно из наиболее изученных семейств диспергированных повторов — так называемое семейство Alu. Члены данного семейства имеют около 300 пар оснований в длину и значимо родственны между собой, хотя не полностью идентичны по нуклеотидному составу. В геноме обнаружено более миллиона повторов Alu-семейства, создающих по крайней мере 10% человеческой ДНК. В то же время в некоторых участках генома они занимают значительно более высокий процент ДНК. Второе семейство этого класса ДНК — длинные диспергированные повторы (сокращенно LINE — от Long Interspersed Nuclear Element или LI) — имеют размеры до 6 килобаз и обнаружены в количестве примерно 850 000 копий, занимая около 20% генома. Они, так же как Alu-повторы, часто концентрируются в определенных участках генома и относительно редко—в других. В ходе подготовки данной статьи для пользователей сайта MedUniver.com использованы труды Гриффите Э., Гуляева Г. В., Гуттмана Б., Дейвиса К., Корфа Б., Мотульски А.М., Морозова Е.И., Притчарда Д., Сузуки Д., Фогеля Ф
 2020-09-24
2020-09-24 479
479






