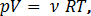 Уравнение Менделеева-Клапейрона:
Уравнение Менделеева-Клапейрона: 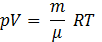 или где
или где
n = m
m
– количество
молей, m – масса газа, m – молярная масса (дается в справочных данных), V [м3] – объем, занимаемый газом; p, [Па] – давление газа; T, [К] – температура; если температура измерена в градусах Цельсия t, [0С], то T = t + 273(К).
Первое начало термодинамики: Q = D U + A, где
Q = c × m × D T
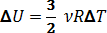
– количество теплоты, с – удельная теплоемкость;
– изменение внутренней энергии газа;
А – работа газа над внешними силами. Если график процесса построен в координатах p-V, то работа может быть найдена как площадь фигуры под графиком процесса.
Некоторые процессы в газах:
И зохорный: V = const; 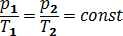 ;
;
A = 0
Þ Q = D U .
Графики изохорного процесса в различных координатах :
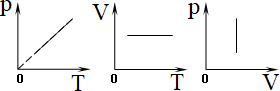
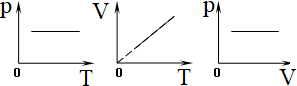
Изобарный: p = const; 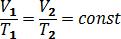 ; A = p (V 2 - V 1 ) = nR D T; Q = ∆U + A;
; A = p (V 2 - V 1 ) = nR D T; Q = ∆U + A; 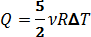 .
.
Графики изобарного процесса в различных координатах:
Изотермический: Т = const; 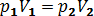 ; ;
; ;
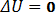
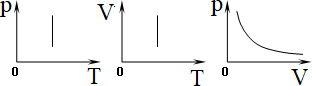
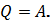 Графики изотермического процесса в различных координатах:
Графики изотермического процесса в различных координатах:
Адиабатный процесс происходит без теплообмена Q = 0; D U = - A.
КПД теплового двигателя:
любого где А – работа двигателя,
Qн – тепло, получаемое от нагревателя, Qх – тепло, отдаваемое холодильнику.
 2020-09-24
2020-09-24 91
91








