Спирты
Цель: изучить строение, номенклатуру, способы получения, физические и химические свойства, применение одноатомных и многоатомных спиртов.
План лекции
1. Строение спиртов
2. Физические свойства
3. Способы получения одноатомных спиртов
4. Химические свойства одноатомных спиртов
5. Способы получения многоатомных спиртов
6. Химические свойства многоатомных спиртов
Спиртами называются производные углеводородов, в молекулах которых содержится одна или несколько гидроксильных групп (-ОН), связанных с насыщенными атомами углерода. Группа -ОН (гидроксильная, оксигруппа) является в молекуле спирта функциональной группой. Систематические названия даются по названию углеводорода с добавлением суффикса - ол и цифры, указывающей положение гидроксигруппы. Нумерация ведется от ближайшего к ОН-группе конца цепи. По числу гидроксильных групп спирты подразделяются на одноатомные (одна группа -ОН), многоатомные (две и более групп -ОН).
Одноатомные спирты: метан ол СН3ОН, этан ол С2Н5ОН;
двухатомный спирт: этиленгликоль (этан диол -1,2) HO–СH2–CH2–OH;
трехатомный спирт: глицерин (пропан триол -1,2,3) HO–СH2–СН(ОН)–CH2–OH.
В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксигруппа, различают спирты
первичные R–CH2–OH,
вторичные R2CH–OH,
третичные R3C–OH.
По строению радикалов, связанных с атомом кислорода, спирты подразделяются на
предельные, или алканолы (СH3CH2–OH),
непредельные, или алкенолы (CH2=CH–CH2–OH),
ароматические (C6H5CH2–OH).
Виды изомерии (структурная изомерия):
1) изомерия положения ОН-группы (начиная с С3);
2) углеродного скелета (начиная с С4);
3) межклассовая изомерия с простыми эфирами (например, этиловый спирт СН3CH2OH и диметиловый эфир CH3–O–CH3).
Следствием полярности связи О–Н и наличия неподелённых пар электронов на атоме кислорода является способность спиртов к образованию водородных связей.
Физические свойства
Спирты, содержащие не более 11 атомов углерода, представляют собой жидкости, высшие гомологи (C12 и более) - твёрдые вещества. Низшие спирты (С1-С3) имеют характерный алкогольный запах и жгучий вкус, обладают сильным физиологическим действием. С4-С6 имеют резкий, неприятный (сивушный) запах.
Первые гомологи хорошо растворяются в воде, по мере увеличения молекулярной массы растворимость падает. Жидкие спирты - хорошие растворители многих органических соединений. Температура кипения спиртов выше, чем температура кипения соответствующих углеводородов и галогенопроизводных. Это определяется главным образом наличием полярной гидроксильной группы и ее способностью обуславливать образование водородных связей (природа водородной связи имеет электростатический и донорно-акцепторный характер) молекулами спирта как между собой, так и с молекулами полярных растворителей.

Отдельные молекулы спиртов соединяются между собой с помощью водородных связей, возникающих между водородом и кислородом атомами гидроксильных групп различных молекул спирта (с участием неподелённой пары электронов кислорода). В многоатомных спиртах наличие нескольких гидроксильных групп приводит к увеличению числа межмолекулярных водородных связей. Такое межмолекулярное связывание ведёт к заметному увеличению вязкости и температуры кипения многоатомных спиртов по сравнению с одноатомными спиртами.
Способы получения
1. CH2=CH2 + H2O/H+® CH3-CH2OH (гидратация алкенов)
2. CH3-CHO + H2  C2H5OH (восстановление альдегидов и кетонов)
C2H5OH (восстановление альдегидов и кетонов)
3. C2H5Br + NaOH (водн.) ® C2H5OH + NaBr (гидролиз галогенопроизводных
ClCH2–CH2Cl + 2NaOH (водн.) ® HOCH2–CH2OH + 2NaCl
4. СO + 2H2  СH3OH (получение метанола)
СH3OH (получение метанола)
5. C6H12O6  2C2H5OH + 2CO2 (брожение глюкозы)
2C2H5OH + 2CO2 (брожение глюкозы)
Химические свойства
Химические свойства спиртов связаны с наличием в их молекуле группы –ОН. Для спиртов характерны два типа реакций: разрыв связи С-О и связи О-Н
1. 2C2H5OH + 2Na ®H2 + 2C2H5ONa (образование алкоголятов металлов Na, K, Mg, Al)
2. а) C2H5OH + HBr ® C2H5Br + H2O;
б) C2H5OH + PCl5 ® C2H5Cl + POCl3 + HCl;
в) C2H5OH + SOCl2 ®C2H5Cl + SO2 + HCl (замещение гидроксильной группы на галоген)
3. C2H5OH + HOC2H5  C2H5-O-C2H5 + H2O (межмолекулярная дегидратация)
C2H5-O-C2H5 + H2O (межмолекулярная дегидратация)
4. C2H5OH 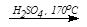 CH2=СН2 + H2O (внутримолекулярная дегидратация)
CH2=СН2 + H2O (внутримолекулярная дегидратация)
5. СН3-СН2ОН + CuO → CH3-CHO + Cu + 2H2O (окисление до альдегидов)
Многоатомные спирты
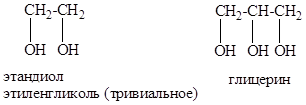
Способы получения
1. 3СH2=CH2 + 2KMnO4+ 4H2O ®3CH2OH-CH2OH+ 2КОН+ 2MnO2 (окисление в мягких условиях, реакция Вагнера), образуется этиленгликоль
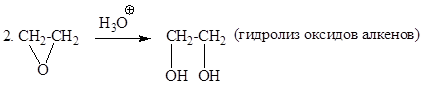
Химические свойства
1. Многоатомные спирты более сильные кислоты, чем одноатомные спирты (большее количество гидроксильных групп, кроме того, они оказывают взаимное влияние друг на друга).
Гликоли и глицерины образуют алкоголяты, аналогично одноатомным спиртам. Отличительным свойством является образование соединений типа хелатов с ионами тяжелых металлов. С Cu(ОН)2 образуется раствор ярко-синего цвета (качественная реакция).


Реакция протекает с избытком реагентов
3. Реакция с HCl, HBr
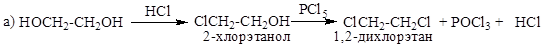

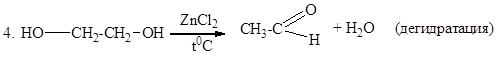
Применение спиртов
Метиловый спирт (метанол) CH3OH: а) производство формальдегида, муравьиной кислоты; б) растворитель.
Этиловый спирт (этанол) С2Н5ОН: а) производство ацетальдегида, уксусной кислоты, бутадиена-1,3, простых и сложных эфиров; б) растворитель для красителей, лекарственных и парфюмерных средств; в) производство ликёро-водочных изделий; г) дезинфицирующее средство в медицине; д) горючее для двигателей, добавка к моторным топливам.
Этиленгликоль HOCH2–CH2OH: а) производство пластмасс; б) компонент антифризов; в) сырьё в органическом синтезе.
Глицерин HOCH2–CH(OH)–CH2OH: а) фармацевтическая и парфюмерная промышленность; б) смягчитель кожи и тканей; в) производство взрывчатых веществ.
 2020-09-24
2020-09-24 100
100







