Насичені одноатомні спирти
 Склад і будова молекул.
Склад і будова молекул.
Спирти можна розглядати як похідні вуглеводнів, у яких атом Гідрогену заміщений на гідроксильну групу –ОН. Залежно від будови вуглеводневого радикалу розрізняють насичені, ненасичені, ароматичні спирти, а за кількістю гідроксильних груп – одно- і багатоатомні.
Найпростіший серед насичених одноатомних спиртів – метанол, його структурна й електронна формули:
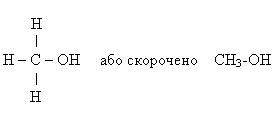
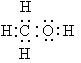
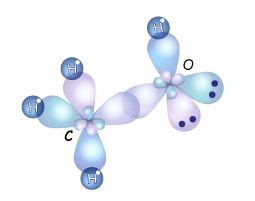
Рис. 3.6.25. Схема утворення s -зв’язків у молекулі метанолу.
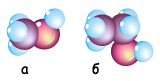
Рис. 3.6.26. Масштабні моделі молекул метанолу (а) та етанолу (б)
Зв'язок О—Н поляризований, оскільки атом більш електронегативного атома Оксигену відтягує до себе електронну густину зв'язку. Внаслідок поляризації на атомі Гідрогену утворюється частковий позитивний, а на атомі Оксигену – частковий негативний заряд:
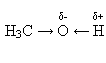
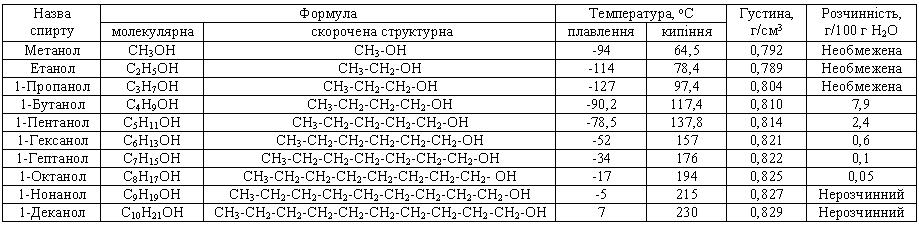
Метанол розпочинає гомологічний ряд насичених одноатомних спиртів. Константи гомологів наведено в таблиці 3.6.10.
Таблиця 3.6.10. Характеристики насичених одноатомних спиртів
Загальна формула насичених одноатомних спиртів 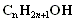 , або R—ОН, де R – вуглеводневий радикал.
, або R—ОН, де R – вуглеводневий радикал.
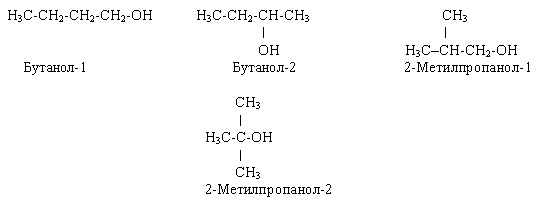
Насиченим одноатомним спиртам властива структурна ізомерія, зумовлена будовою карбонового ланцюга і положення гідроксильних груп. Для спирту складу  можливі такі ізомери:
можливі такі ізомери:
 Фізичні властивості.
Фізичні властивості.
Насичені одноатомні спирти – рідкі або кристалічні (вищі спирти) речовини, безбарвні, зі специфічним запахом. Серед спиртів, на відміну від вуглеводнів, немає газуватих речовин. Температури плавлення і кипіння спиртів значно вищі порівняно з вуглеводнями з такою самою відносною молекулярною масою (табл. 3.6.11.)
Таблиця 3.6.11. Температури кипіння вуглеводнів і спиртів 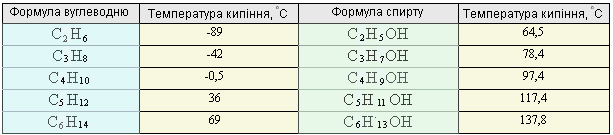
Таку відмінність цих констант пояснюють наявністю додаткової взаємодії між полярними молекулами спирту. За рахунок притягування позитивно зарядженого атома Гідрогену однієї молекули і негативно зарядженого атома Оксигену іншої молекули утворюється так званий водневий зв'язок (позначають його крапками).
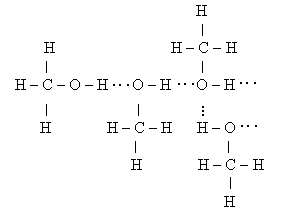
|
Водневі зв'язки утворюються також між молекулами води, амоніаку.
Унаслідок утворення водневих зв'язків між молекулами води і спиртів останні розчиняються у воді:
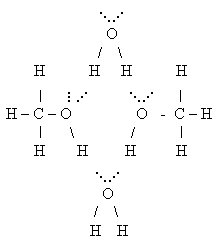
Зі зростанням вуглеводневого радикала в молекулі розчинність спиртів зменшується.
 Хімічні властивості.
Хімічні властивості.
Наявність у молекулах спиртів гідроксильної групи зумовлює характерні хімічні властивості (хімічні функції) цих сполук.
|
Гідроксильна група – функціональна група спиртів.

1. Горіння. Спирти горять з виділенням вуглекислого газу, води і теплоти. Метанол і етанол миттєво спалахують і горять синюватим, майже непомітним полум'ям.
2. Часткове окиснення спиртів калій перманганатом у кислому середовищі відбувається з утворенням альдегідів і карбонових кислот. При цьому функціональна гідроксильна група окиснюється до альдегідної і карбоксильної груп, характерних для цих сполук.
3. Заміщення. Завдяки тому, що електронна густина зв'язку О—Н зміщена до атома Оксигену, атом Гідрогену набуває рухливості й здатності заміщуватись на атоми активних металів.
Реакції спиртів можуть відбуватись також з відщепленням гідроксильної групи, до яких належить реакція з гідрогенбромідом. Гідроксильна група спирту заміщується на атом Брому, утворюється бромопохідна сполука вуглеводню.
4. Дегідратація. Перебіг реакції визначається її умовами. Якщо етанол нагрівати до температури 140оС з концентрованою сульфатною кислотою, відбувається міжмолекулярна дегідратація (відщеплення води) з утворенням діетилового етеру -- сполуки, що належить до класу етерів. За температури понад 170оС відбувається реакція внутрішньомолекулярної дегідратації та утворюється етилен.
 Добування.
Добування.
Спирти добувають як із природної сировини (глюкоза, деревина), так і синтетичним шляхом.
 2020-09-24
2020-09-24 123
123







