Галогенирование фенолов не требует катализа кислотами Льюиса (FeCl3, FeBr3, AlCl3 и др.) и легко осуществляется под действием молекулярного галогена. Галогенирование фенола молекулярным бромом или хлором в полярной среде практически невозможно остановить на стадии моногалогенирования, поскольку реагирующей частицей здесь является фенолят-ион. Фенолят-ион содержит очень сильную активирующую группу - анион кислорода и скорость галогенирования фенолят-иона по крайней мере в тысячу раз выше, чем фенола. Галогензамещенный фенол является более сильной кислотой, чем фенол, он легче диссоциирует, что облегчает введение второго и третьего атома галогена в орто- и пара-положения.
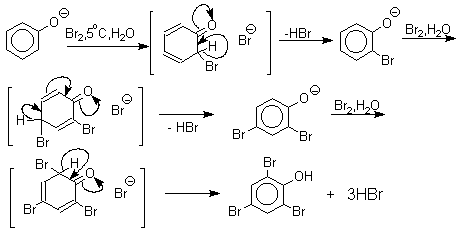
Бромирование фенола в воде приводит к образованию нерастворимого 2,4,6-трибромфенола. Эта реакция настолько чувствительна, что позволяет обнаружить фенол в концентрации 10- 5 М в водном растворе. 2,4,6-трибромфенол взаимодействует еще с одним молем брома с образованием 2,4,4,6-тетрабромциклогекса-2,5-диенона, окрашенного в желтый цвет.
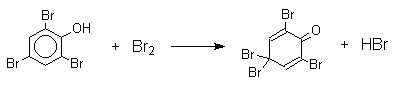
При обработке продукта этой реакции раствором гидросульфита натрия или другого слабого восстановителя он легко превращается в исходный 2,4,6-трибромфенол. Производные циклогексадиенонов могут быть выделены при бромировании 2,6-ди- и 2,4,6-тризамещенных пространственно затрудненных фенолов.
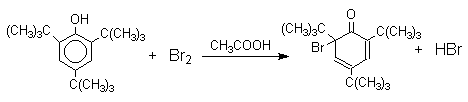
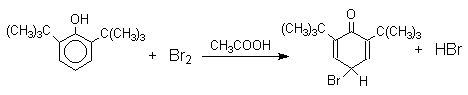
При бромировании фенола в растворе бромистоводородной кислоты или при хлорировании в соляной кислоте диссоциация полностью подавляется и галогенированию подвергается сам фенол. При этом в зависимости от условий и количества галогена может быть получен п-бромфенол или 2,4-дибромфенол.
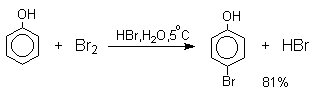
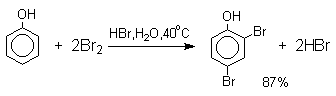
Аналогичным образом протекает и хлорирование фенола, но здесь получается значительное количество о-хлорфенола. Моногалогензамещенные производные фенолов удобно получать при галогенировании в неполярной среде, что также исключает диссоциацию фенолов.
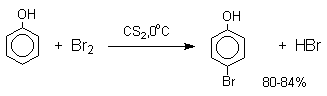
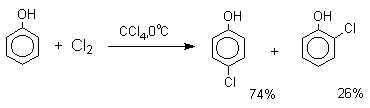
В качестве галогенирующего агента кроме самих галогенов можно использовать комплексы галогенов с диоксаном, ДМФА.
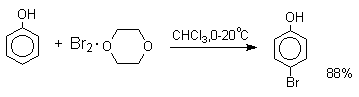
Во всех случаях соотношение пара/орто-изомеров при бромировании и иодировании значительно выше, чем при хлорировании.
Нитрование фенолов
Нитрование фенолов разбавленной 20-25%-ной азотной кислотой приводит к получению смеси орто- и пара-нитрофенолов.
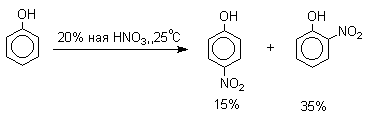
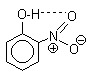
Их легко разделить с помощью перегонки с водяным паром, где летучим оказывается только орто-изомер. Летучесть орто-нитрофенолов обусловлена образованием прочной внутримолекулярной водородной связи:
Даже в таких мягких условиях нитрование сопровождается окислением фенола и этот процесс становится доминирующим, если для нитрования использовать концентрированную азотную кислоту. Поэтому для получения 2,4,6-тринитрофенола (пикриновой кислоты) используют видоизмененный способ нитрования. Фенол первоначально сульфируют до 4-гидрокси-1,3-бензолдисульфокислоты, а затем нитруют азотной кислотой.
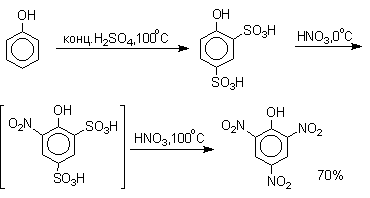
Вторая стадия по существу представляет собой электрофильное ипсо-замещение сульфогруппы на нитрогруппу. Пикриновая кислота широко применяется в качестве сильного акцептора для получения стабильных комплексов с переносом заряда (донорно-акцепторных комплексов) с конденсированными ароматическими углеводородами, пентаметилбензолом и многими другими ароматическими углеводородами.
Для нитрования фенолов в качестве нитрующего агента кроме азотной кислоты можно использовать ацетилнитрат и N2O4, эти реагенты способствуют преимущественному нитрованию в орто-положение к гидроксильной группе.
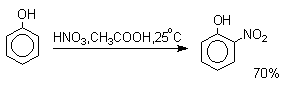
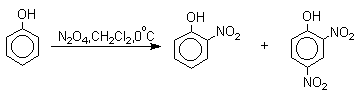
 2020-09-24
2020-09-24 183
183








