Образуется при взаимодействии атомов, ЭО которых отличается незначительно, например молекула Н Сl Н ЭО-2.1; Сl ЭО-2.89

Лайнус Полинг показал, что при образовании связи может происходить sp3, sp2 и sp гибридизация.
Гибридизация – это выравнивание электронных облаков по форме и энергии, с целью достижения максимального перекрывания при образовании химической связи.
1) Примеры sp3 гибридизации: молекулы CH4, H2O, NH3, SiH4, PH3.
В пространстве гибридные sp3 облака направлены к вершинам тетраэдра. Тетраэдрический угол 109◦28 в молекуле CH4. Рассмотрим строение молекулы NH3:
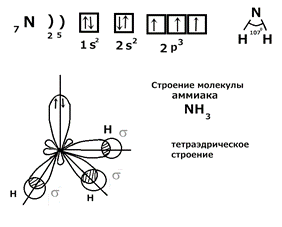
Строение молекулы H2O: сжатие угла связанно с увеличением числа неподеленных электронных пар.

Вывод: молекулы в sp3 гибридизации имеют тетраэдрическое строение.
2) Пример sp2 гибридизации: BCl3.

В пространстве гибридные sp2 орбитали располагаются в одной плоскости под углом 120 градусов, а негибридная p -орбиталь располагается перпендикулярно этой плоскости
3) Пример sp гибридизации: Be Cl2

В пространстве гибридные sp – орбитали располагаются по прямой, а две негибридные p –орбитали располагаются перпендикулярно этой прямой.
 2020-09-24
2020-09-24 141
141








