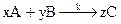
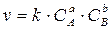
Здесь k – константа скорости химической реакции;
а – порядок реакции по веществу А n(А);
b – порядок реакции по веществу В n(В);
(a+b) – общий порядок реакции n.
Порядки реакции можно считать равными стехиометрическим коэффициентам ТОЛЬКО для элементарных, т.е. одностадийных процессов. Поскольку уравнение химической реакции отражает только начальное и конечное состояние системы, но не отражает ее механизм, то в общем случае порядки реакции НЕ СОВПАДАЮТ с ее стехиометрическими коэффициентами. Скорость реакции в целом определяется скоростьопределяющей (лимитирующей) стадией.
В случае гетерогенной реакции в выражение закона действующих масс входят только концентрации газообразных веществ, если они есть среди реагентов, либо веществ, находящихся в растворе. Концентрации твердых веществ никогда не входят в выражение закона действующих масс, т.к. реакции протекают на их поверхности, а площадь поверхности в реакции не изменяется.
Основные факторы, влияющие на скорость реакций
Концентрации реагирующих веществ (парциальные давления)
при увеличении концентрации (парциального давления) реагирующего вещества скорость химической реакции возрастает пропорционально изменению концентрации (парциального давления) в степени порядка реакции по данному веществу:
H2 + Br2 ® 2HBr 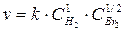
При увеличении концентрации водорода в 3 раза скорость реакции увеличиться в 31 = 3 раза. При уменьшении парциального давления брома в 4 раза скорость реакции уменьшится в 41/2 = 2 раза.
Давление
при увеличении давления для газофазных реакций происходит пропорциональное увеличение всех парциальных давлений; следовательно, скорость возрастает пропорционально изменению давления в степени суммарного порядка реакции:
H2(г) + Br2(г) ® 2HBr 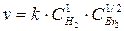
При увеличении давления в 9 раз, парциальные давления водорода и брома увеличиваются в 9 раз, следовательно, скорость реакции увеличивается в 91·91/2 = 9·3=27 раз.
Объем
при изменении объема, давление в системе (или концентрации всех зообразных веществ) уменьшаются обратно пропорционально; следовательно уменьшение объема в n раз эквивалентно увеличению общего давления в n раз или возрастанию всех концентраций в n раз.
 2020-09-24
2020-09-24 76
76








