а) определяет, какие из процессов в данной системе при заданных условиях могут протекать самопроизвольно.
б) устанавливают предел возможного самопроизвольного протекания процессов, то есть каково состояние равновесия.
в) дает возможность определить, какими должны быть внешние условия, чтобы интересующий нас процесс протекал в нужном направлении и в нужной степени.
Это имеет большое значение для решения научных и технологических задач
Прежде чем переходить к содержанию второго закона, необходимо ознакомиться еще с одной термодинамической функцией, называемой энтропией S.
Энтропия является функцией состояния, то есть ее изменение (Δ S) в каком-либо процессе зависит только от начальной и конечной величины:
Δ S = S 2 – S 1.
Чтобы уяснить сущность энтропии, рассмотрим понятие о термодинамической вероятности системы (W).
Одно и то же макросостояние системы, то есть состояние, задаваемое термодинамическими параметрами, может существовать при различном распределении энергии между отдельными молекулами, то есть состоять из большого числа микросостояний. Например, для характеристики состояния некоторой массы вещества, являющейся совокупностью очень большого числа молекул, нужно или указать параметры состояния системы, или указать мгновенные координаты каждой молекулы (xi, уi, zi) и скорости перемещения по всем направлениям. В первом случае характеризуется макросостояние системы, а во втором – микросостояние. Каждому макросостоянию отвечает огромное число микросостояний.
Например, даже для двух молекул число микросостояний, с помощью которых может быть осуществлено данное макросостояние, равно 4, для 10 молекул газа примерно 1000.
Число микросостояний, с помощью которых может быть осуществлено данное макросостояние, называется термодинамической вероятностью системы(W).
Состояние макросистемы, которое реализуется малым числом микросостояний, называют упорядоченным или порядком.
В противоположность ему макросостояние, осуществляемое большим числом микросостояний, называется беспорядочным или коротко хаосом.
Энтропия (S) - это количественная мера хаоса, беспорядка. по предположению Больцмана, ее следует измерять величиной, пропорциональной логарифму числа возможных микросостояний системы (W). Коэффициентом пропорциональности служит постоянная Больцмана (К). Таким образом,
S = K ln W. (3.6)
Из формулы Больцмана видно, что энтропия определяется только числом микросостояний:
К = 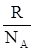 ,
,
где R – универсальная газовая постоянная;
NA – число Авогадро.
Из уравнения (3.6) следует, что энтропия системы увеличивается пропорционально логарифму термодинамической вероятности системы (W).
Представим себе 1 моль воды (6,02•1023 молекул) при комнатной температуре и атмосферном давлении. Пусть W Н2О(ж) – термодинамическая вероятность состояния этой системы. При понижении температуры до 0 0С вода замерзает, превращается в лед, при этом молекулы Н2О как бы закрепляются в узлах кристаллической решетки и термодинамическая вероятность этой системы уменьшается: W Н2О(к) < W Н2О(ж). Следовательно, уменьшается и энтропия системы: S Н2О(к) < S Н2О(ж). Наоборот, при повышении температуры до 100 0С вода закипает, превращается в пар; при этом термодинамическая вероятность состояния системы увеличивается: W Н2О(г) > W Н2О(ж). Следовательно, растет и энтропия системы: S Н2О(г) > S Н2О(ж). Сказанное позволяет сделать вывод: энтропия является мерой хаотичности, неупорядоченности системы.
Носителями энтропии являются газы. Если при реакции увеличивается число молей газообразных веществ, то увеличивается и энтропия системы. Например, СаСО3(к) = СаО(к) + СО2(г); Δ S > 0. Изменение энтропии Δ S определяется разностью S 2 – S 1, в которой S 2 – сумма энтропий всех продуктов реакции, а S 1 – сумма энтропий всех исходных веществ.
Δ S 0 = Σ ni S 0 - Σ ni S 0, (3.7)
Продуктов Исходных веществ
где ni – соответствующие стехиометрические коэффициенты участвующих в реакции веществ;
S 0 – стандартная энтальпия – энтальпия 1 моль вещества в его стандартном состоянии.
Следует отметить, что для простых веществ энтропии, в отличие от энтальпий образования, не равны нулю. Стандартные энтропии многих простых и сложных веществ приводятся в таблицах (см. прил.).
Пример. Рассчитать изменения стандартной энтропии в реакции синтеза аммиака: N2 + 3H2 = 2NH3.
Решение. по таблице находим значение стандартных абсолютных энтропий: S 0NH3(г) = 193 Дж/моль•К;
S 0N2(г) = 192 Дж/моль•К;
S 0H2(г) = 131 Дж/моль•К.
Δ S 0 = 2• S 0NH3(г) – (S 0N2(г) + 3 • S 0H2(г));
Δ S 0 = 2моль • 193 Дж/моль•К – 192 Дж/моль•К – 3 моль •131 Дж/моль•К = - 195 Дж/К.
В рассмотренном примере энтропия уменьшается (Δ S < 0). Это можно было ожидать, если учесть, что в результате реакции уменьшается объем газообразных веществ, а следовательно, уменьшается неупорядоченность в системе.
В изолированных системах, не обменивающихся с внешней средой ни теплотой, ни работой, самопроизвольно протекают только те процессы, которые сопровождаются ростом энтропии системы: ΔS >0. Когда энтропия достигает максимального для данных условий значения, в системе устанавливается состояние равновесия (ΔS = 0).
Это одна из формулировок второго закона термодинамики.
Энергия Гиббса
Химические процессы чаще всего протекают при постоянных давлении и температуре. Для выяснения возможности самопроизвольного протекания изобарно-изотермических процессов применяется термодинамическая функция G, называемая энергией Гиббса, или изобарно-изотермическим потенциалом:
G = H – TS. (3.8)
Δ G – энергия Гиббса химической реакции.
Подобно энтальпии абсолютные значения энергии Гиббса системы определить невозможно, но можно определить ее изменения при различных процессах.
Энергия Гиббса – термодинамическая функция состояния, так как ее изменения не зависят от пути перехода из начального состояния в конечное.
Для вычисления Δ G пользуются справочными значениями стандартной энергии Гиббса образования сложных веществ из простых веществ Δ G 0.
Δ G 0 – это энергия Гиббса реакция образования 1 моля сложного вещества при Т = 298 К и давлении 101,3 кПа из простых веществ устойчивых при данных условиях.
Δ G = Σ ni Δ G 0 - Σ ni Δ G 0, (3.9)
Продуктов Исходных веществ
Δ G = Δ Н 0 - Т Δ S.
По величине ΔG судят о возможности самопроизвольного протекания изобарно-изотермических процессов.
При постоянном давлении и температуре самопроизвольно могут протекать только процессы, сопровождающиеся уменьшением G (ΔG < 0); пределом их протекания, то есть условием равновесия, является достижение некоторого минимального значения G.
Пример. Будет ли самопроизвольно протекать при стандартных условиях (Т = const = 298 К; р = const = 101,3 кПа) реакция синтеза аммиака: N2 + 3H2 = 2NH3?
Решение. Δ G = Δ Н - Т Δ S. Исходя из первого следствия закона Гесса, находим Δ Н 0 = -92,38 кДж/моль. Δ S 0 = - 195 Дж/К.
Δ G = - 92,38 – 298 (-195)•10–3 = -34,27 кДж.
Следовательно, данная реакция при стандартных условиях будет протекать самопроизвольно.
Следует помнить, что большинство химических реакций является химически обратимыми,то есть протекают одновременно в двух противоположных направлениях. Полученное отрицательное значение G указывает на то, что самопроизвольно может протекать прямая реакция. Если в результате расчета величина Δ G оказывается положительной, это указывает на возможность самопроизвольного протекания обратной реакции.
 2020-10-10
2020-10-10 136
136








