ИССЛЕДОВАНИЕ ИЗМЕНЕНИЯ ЭНТРОПИИ
В НЕОБРАТИМЫХ АДИАБАТНЫХ ПРОЦЕССАХ
Цель работы: определение изменения энтропии изолированной системы тел при их тепловом необратимом адиабатном процессе взаимодействия.
Краткая теория
Для описания поведения систем немецкий физик Рудольф Клаузиус ввел функцию параметров состояния, названную им энтропией. Пользуясь понятием энтропии, основное содержание II начала термодинамики можно сформулировать следующим образом: любой процесс в изолированной системе подчиняется условию:
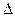 S
S 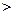 0, (1)
0, (1)
где 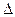 S – изменение энтропии. Это означает, что при переходе замкнутой системы из одного состояния в другое энтропия либо увеличивается, либо остается неизменной.
S – изменение энтропии. Это означает, что при переходе замкнутой системы из одного состояния в другое энтропия либо увеличивается, либо остается неизменной.
Более кратко II начало термодинамики можно сформулировать так: в процессах изолированной системы энтропия не убывает. В этом утверждении существенно, что оно относится к изолированным системам, в неизолированных системах энтропия может и возрастать, и убывать, и оставаться неизменной в зависимости от характера процесса. Отметим, что неизменной в неизолированной системе энтропия остается лишь при обратимых процессах, в необратимых же процессах она возрастает. Поскольку в предоставленной самой себе (изолированной) системе процессы идут, как правило, необратимо, это означает, что практически энтропия изолированной системы всегда растет. Рост энтропии означает приближение системы к состоянию термодинамического равновесия.
Таким образом, первое начало термодинамики описывает количественные отношения между величинами, характеризующими систему, при различных изменениях в состоянии системы, но ничего не говорит о направлении этих изменений. Второе начало термодинамики указывает направление изменений в системе, если они должны произойти, или на отсутствие изменений, если они не могут произойти.
Теория метода
В данной работе предлагается измерить изменение энтропии изолированной системы, в которой происходит необратимый процесс теплообмена. Вычисление основывается на том, что энтропия является функцией состояния.
Если система перешла из одного состояния в другое посредством необратимого процесса, то логично мысленно перевести систему из первого состояния во второе с помощью некоторого обратимого процесса и рассчитать происходящее при этом изменение энтропии. Оно равно изменению энтропии при необратимом процессе.
Рассмотрим изменение энтропии при выравнивании температуры двух тел, приведенных в тепловой контакт. Для упрощения расчета считаем, что теплообмен происходит при постоянном объеме каждого из тел, теплоемкости с1 и с2 не зависят от температуры, Т1>Т2. Для определения температуры Т3, которую будут иметь тела по достижении термодинамического равновесия, можно написать выражение:
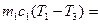
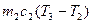 , (1)
, (1)
из которого следует, что
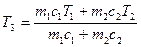 . (2)
. (2)
Переход из состояния 1 в состояние 2 схематически представлен на рис.1.
 Рассмотрим необратимый процесс теплообмена при контакте двух тел. В исходном состоянии тела массами
Рассмотрим необратимый процесс теплообмена при контакте двух тел. В исходном состоянии тела массами 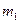 и
и 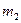 изолированы друг от друга и имеют разную температуру. Затем они приводятся в тепловой контакт. В результате теплообмена они приходят в состояние 2. Однако переход из состояния 1 в состояние 2 можно совершить так же и с помощью обратимых процессов. В этом случае тела считаются изолированными (рис. 1б) и каждое из них обратимым процессом приводится в состояние 2 при одинаковой температуре Т3. После этого они приводятся в контакт, но это никакого изменения в их состояние не вносит. Таким образом, в обоих случаях начальное и конечное состояния одинаковы и изменение энтропии можно рассчитать с помощью обратимого процесса по формуле:
изолированы друг от друга и имеют разную температуру. Затем они приводятся в тепловой контакт. В результате теплообмена они приходят в состояние 2. Однако переход из состояния 1 в состояние 2 можно совершить так же и с помощью обратимых процессов. В этом случае тела считаются изолированными (рис. 1б) и каждое из них обратимым процессом приводится в состояние 2 при одинаковой температуре Т3. После этого они приводятся в контакт, но это никакого изменения в их состояние не вносит. Таким образом, в обоих случаях начальное и конечное состояния одинаковы и изменение энтропии можно рассчитать с помощью обратимого процесса по формуле:
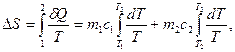 (3)
(3)
где 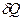 = mcdT.
= mcdT.
Вычислив интегралы, получим:
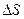 = m1c1 ln
= m1c1 ln 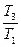 + m2c2 ln
+ m2c2 ln 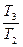 . (4)
. (4)
Данное выражение и показывает изменение энтропии в необратимом процессе. С помощью (2) прямой подстановкой в (4) убеждаемся, что 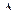 S > 0.
S > 0.
Таким образом, энтропия при теплообмене увеличивается.
 2020-10-10
2020-10-10 526
526








