Классификация и номенклатура.


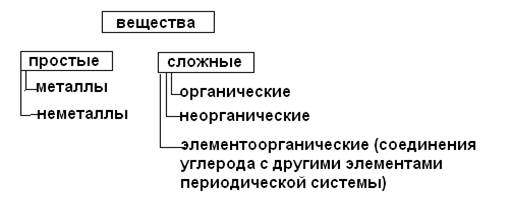
По составу неорганические вещества разделяются на двухэлементные (бинарные) и многоэлементные. К первым относятся: оксиды, галогениды, халькогениды, нитриды, гидриды, карбиды, силициды, бориды. Среди многоэлементных соединений важную группу составляют гидроксиды - вещества, содержащие гидроксогруппы ОН─.
(свойства кислот) (свойства оснований) (свойства как оснований,
так и кислот)
По функциональным признакам неорганические вещества классифицируют на классы: ● оксиды; ● кислоты; ● основания; ● соли.
Оксидами называются сложные вещества, состоящие из двух элементов, один из которых кислород в степени окисления ─2: (Na2O, CO2, ZnO).

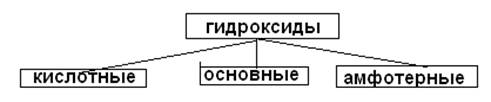
Основными называют оксиды, взаимодействующие с кислотами (или кислотными оксидами) с образованием солей. Кислотными называют оксиды, взаимодействующие с основаниями (или основными оксидами) с образованием солей. Амфотерными называются оксиды, образующие соли при взаимодействии как с основаниями (щелочами), так и с кислотами.
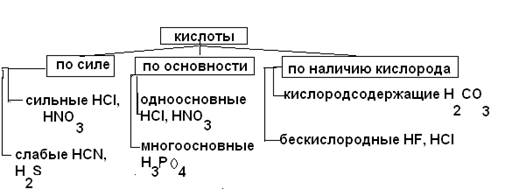
Кислотами называются сложные вещества, состоящие из атомов водорода и кислотного остатка.
Основаниями называются сложные вещества, состоящие из атомов металла и одной или нескольких гидроксогрупп.

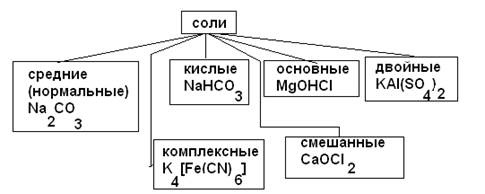
Солями называются сложные вещества, состоящие из основного и кислотного остатков.
Названия бинарных соединений образуются из латинских названий элементов с окончанием –ид и русского названия менее электроотрицательного элемента в родительном падеже: NaCl – хлорид натрия, СaC2 – карбид кальция. Если менее электроотрицательный элемент может находиться в разных степенях окисления, то после его названия в скобках указывается его валентность. Можно вместо валентности с помощью греческих числительных приставок (моно-, ди-, три, тетра-) указать стехиометрический состав соединения:
CO – оксид углерода (II) или монооксид углерода, CO2 - оксид углерода (IV) или диоксид углерода, SF6 – фторид серы (VI) или гексафторид серы. Для отдельных бинарных соединений сохраняются традиционные названия: Н2О - вода, NH3 - аммиак, РН3 – фосфин.
Существуют вещества, которые по составу похожи на оксиды, а по строению и свойствам относятся к солям. Это пероксиды, соли очень слабой кислоты – пероксида водорода Н2О2. Например, ВаО2, Na2O2. К солеобразным веществам относятся и такие вещества, как Рb2O3, Pb3O4.
Названия основных гидроксидов составляются из слов "гидроксид" и русского названия элемента в родительном падеже с указанием, если необходимо, валентности (римскими цифрами в скобках): CuOН – гидроксид меди (I), Cu(ОН)2 – гидроксид меди (II).
Названия бескислородных кислот, составляют добавляя к корню русского названия кислотообразующего элемента (или к названию группы атомов, например СN─ - циан) суффикс " О " и окончание "водородная кислота": HCl – хлороводородная кислота, НСN – циановодородная кислота.
Названия кислородсодержащих кислот образуются от русского названия соответствующего элемента с добавлением слова " кислота ". Если элемент – кислотообразователь находится в высшей степени окисления, для названия используют окончания -ная или –овая, например: HNO3 - азотная кислота, H3AsO4 - мышьяковая кислота. С понижением степени окисления элемента – кислотообразователя окончание изменяется в следующей последовательности: -новатая, -истая, -оватистая.
Названия кислот, содержащих группировку атомов –О-О-, рассматриваются как производные пероксида водорода, снабжаются приставками – пероксо и, если необходимо, греческим числительным, указывающего на число атомов кислотообразующего элемента в молекуле кислоты. Например, H2SO5 -пероксосерная кислота, H2S2O8 - надсерная кислота.
Если одному и тому же кислотному оксиду соответствуют несколько кислот, то к названию кислоты, содержащей наименьшее число атомов кислорода, добавляется приставка – мета, а к названию кислоты, содержащей наибольшее число атомов кислорода, приставка – орто H2SiO3 - метакремниевая кислота, H4SiO4 - ортокремниевая кислота.
Названия солей образуются из названий аниона в именительном падеже и названия катиона в родительном падеже. Название аниона состоит из корня латинского названия элемента - кислотообразователя. Анионы бескислородных кислот получают окончание – ид. Например, F─ -фторид, S2─ - сульфид, CN─ - цианид. Окончания, используемые в названиях анионов кислородных кислот, зависят от степени окисления кислотообразователя (для высшей степени окисления используют окончание – ат. Например: HNO3 - кислота азот ная → NO3─ - нитр ат, H2SO 4 - сер ная кислота → SO42─ - сульф ат, H3PO4 - фосфор ная кислота → PO43─ - фосф ат. К названиям кислот, содержащих несколько атомов кислотообразующего элемента, добавляются греческие числительные приставки, указывающие число этих атомов, например, соли дисерной кислоты H2S2O7 называются дисульфатами, тетраборной кислота H2B4O7 – тетраборатами. Анионы, содержащие атомы водорода, получают приставку гидро-, например, HPO42─ -гидрофосфат, H2PO4─ - дигидрофосфат.
Аналогично катионы, содержащие группу ОН─ получают приставку – гидроксо, например, катион AlOH2+ называют гидроксоалюминием, катион Al(OH)2+ называют дигидроксоалюминием.
Химические свойства основных классов неорганических соединений представлены в таблице 1.
 2020-10-10
2020-10-10 523
523








