| n |
| m l | ms | Состояние электрона | Число электронов | |
| на подуровне | на уровне | |||||
| 1 | 0 | 0 | ±½ | 1s | 2 | 2 |
| 2 | 0 1 | 0 -1, 0, +1 | ±½ | 2s 2p | 2 6 | 8 |
| 3 | 0 1 2 | 0 -1, 0, +1 -2, -1, 0, +1, +2 | ±½ | 3s 3p 3d | 2 6 10 | 18 |
| 4 | 0 1 2 3 | 0 -1, 0, +1 -2, -1, 0, +1, +2 -3, -2, -1, 0, +1, +2, +3 | ±½ | 4s 4p 4d 4f | 2 6 10 14 | 32 |
3. Правило Хунда: Орбитали в пределах данного подуровня заполняются сначала по одному электрону, т.е. каждый электрон располагается в отдельной квантовой ячейке в виде неспаренного электрона. Другими словами, при данном значении 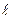 электроны располагаются так, чтобы суммарное спиновое число их (∑ms) было максимально. Суммарный спин спаренных электронов равен нулю. Например, если три p – орбитали (р x, р y, р z) надо заполнить р – электронами, то они должны в начале распределяться по одному на каждой отдельной орбитали (ячейке), а затем по два с противоположными спинами.
электроны располагаются так, чтобы суммарное спиновое число их (∑ms) было максимально. Суммарный спин спаренных электронов равен нулю. Например, если три p – орбитали (р x, р y, р z) надо заполнить р – электронами, то они должны в начале распределяться по одному на каждой отдельной орбитали (ячейке), а затем по два с противоположными спинами.
Строение электронных оболочек атомов теcно связано с расположением элементов в периодической системе химических элементов Д. И. Менделеева. Порядковый номер элемента указывает на заряд ядра его (число протонов) и на число электронов.
Номер периода (главное квантовое число n) указывает на число энергетических уровней и на число подуровней в данном энергетическом уровне. А квадрат главного квантового числа определяет число квантовых ячеек на уровне.
В зависимости от того, на какой энергетический уровень в атоме поступает последний электрон, элементы делятся на s-, p-, d-, f- элементы. При этом
s - элементы находятся в главных подгруппах 1 и 2 групп периодической системы (а также H и He), p - элементы находятся в главных подгруппах 3, 4, 5, 6, 7 и 8 групп периодической системы; d - элементы находятся в побочных подгруппах любых групп периодической системы.
У s - и p - элементов на внешнем энергетическом уровне число электронов соответствует номеру группы периодической системы, а у d - элементов на внешнем уровне не больше 1-2 электронов.
. Распределение электронов по уровням и подуровням в атоме записывается в виде электронных формул. Чтобы составить электронную или графическую формулу любого элемента, надо знать номер химического элемента, номер периода, где находится этот элемент, а также номер группы и подгруппы (главная или побочная) в периодической системе и перечисленные выше положения. Электронная формула серы будет составляться следующим образом: порядковый номер серы 16, следовательно у атома серы 16 электронов; т.к, сера находится в третьем периоде (n =3), то её электроны располагаются на трёх энергетических уровнях.
Третий уровень состоит из трёх подуровней (3 s, 3 p, 3 d) на третьем уровне будет 9 (n2) энергетических ячеек, т.к. сера находится в шестой группе главной (А) подгруппе, то на внешнем энергетическом уровне у неё будет 6 электронов: 3 s 23 p 4. В свете сказанного электронная формула атома серы будет иметь следующий вид 16S 1 s 22 s 22 p 63 s 23 p 4.
Электронно - графическая формула распределения электронов атома серы по квантовым ячейкам имеет вид:
| ↑↓ | ↑↓ | ↑ | ↑ | |||||
| ↑↓ | ↑↓ | ↑↓ | ↑↓ | |||||
| ↑↓ | ||||||||
s p d
Распределение электронов в атоме по уровням, подуровням и орбиталям описывают электронно-графические формулы.
В каждой квантовой ячейке может быть не более двух электронов с противоположными спинами (принцип Паули). Орбитали одного подуровня заполняются таким образом, чтобы суммарное спиновое квантовое число было максимальным (правило Хунда).
Пример 1. Составьте электронную и электронно – графическую формулу атома ванадия.
Р е ш е н и е. Так как элемент ванадий находится в четвёртом периоде, то электроны его атомов располагаются на четырёх энергетических уровнях: на первом уровне 2 электрона, на втором 8. Т.к. ванадий находится в Vгруппе, побочной подгруппе, то у его атомов на внешнем энергетическом уровне будет два электрона, а остальные 11 электронов разместятся на третьем энергетическом уровне. Ванадий относится к d -электронному семейству. Электронная формула ванадия: 1 s 22 s 22 p 63 s 23 p 63 d 34 s 2
Для атома ванадия электронно-графическая схема распределения электронов имеет вид:
| ↑↓ | ||||||||
| ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ | ↑ | ↑ | ||
| ↑↓ | ↑↓ | ↑↓ | ↑↓ | |||||
| ↑↓ | ||||||||
s p d
Число неспаренных электронов в атоме определяется правилом Хунда и наличием свободных ячеек (АО) в том же квантовом слое.
При возбуждении атома электроны могут переходить на эти свободные ячейки, а атом проявлять большую валентность. Это имеет место лишь в том случае, когда необходимая для возбуждения атома энергия, компенсируется энергией, выделяющейся при образовании нового соединения. Распариваются тоько атомы последнего энергетическоо уровня.
 2020-10-10
2020-10-10 269
269








