1. Вдоль межъядерной оси – сигма связь (σ)
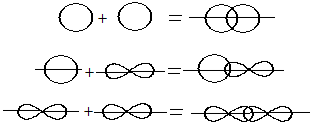
2. По обе стороны от межъядерной оси – за счёт бокового перекрывания орбиталей - Пи-связь (π)
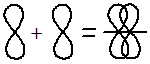
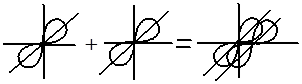
Перекрывание электронных облаков над и под линией, соединяющей ядра атомов, осуществляется за счёт так называемой π – связи. Если d – электронные облака, расположенные в параллельных плоскостях, перекрываются всеми четырьмя лепестками, то такую связь называют дельта связью (δ). В молекулах с двойной и тройной связью имеются и σ - и π – связи.
Следует различать понятия «полярность связи» и «полярность молекулы». Например, и σ- и π- связь С=О полярны, а молекула СО2 неполярна, т.к. суммарный дипольный момент молекулы равен нулю.
Ионная связь. Такой тип химической связи возникает только при взаимодействии атомов, которые сильно отличаются по электроотрицательности, т.е. между типичными металлами и типичными неметаллами.
При химическом взаимодействии типичные металлы, имеющие на внешнем энергетическом уровне 1 – 2 электрона, отдают их атому неметалла, который приобретает завершённый энергетический уровень и превращается в отрицательно заряжённый ион, а атом, отдавший электроны – в положительно заряженный ион. Например NaCl:
Na0 1 s 22 s 22 p 63 s 1 - e → Na+ 1 s 22 s 22 p 63 s 0
Сl0 1 s 22 s 22 p 63 s 23 p 5 + е → Сl¯ 1 s 22 s 22 p 63 s 23 p 6
Между образовавшимися ионами осуществляется электростатическое взаимодействие, приводящее к образованию химического соединения. Химическая связь между ионами, осуществляемая электростатическим притяжением, называется ионной или электровалентной связью.
[Na+][Cl-]
Соединения, которые образовались за счёт притяжения ионов, называются гетерополярными или ионными. Ионные соединения состоят из молекул только в парообразном состоянии.
Ионная связь в отличие от ковалентной характеризуется ненаправленностью в пространстве и ненасыщаемостью. Квантово - механическая теория валентности указывает, что резкого различия между ионной и ковалентной полярной связью не существует. Ионная связь это предельный случай полярной ковалентной связи.
Металлическая связь – сильно делокализованная химическая связь. Возникает в том случае, когда атомы имеют мало валентных электронов по сравнению с количеством свободных валентных орбиталей, валентные электроны слабо удерживаются ядром из – за малой энергии ионизации. Наличие в металле так называемых свободных электронов (электронного газа) характеризует многие общие для всех металлов свойства: металлический блеск, теплопроводность и электрическую проводимость.
Свободные электроны связывают друг с другом ионы.
Данный вид связи характерен для металлов и их сплавов, а так же для интерметаллических соединений, она ненасыщенна и ненаправлена.
В одородная связь. Межмолекулярное взаимодействие может осуществляться не только за счёт донорно – акцепторных связей, но и за счёт сил Ван-дер-Ваальса (дисперсионного, ориентационного и индукционного взаимодействия) и водородной связи. Водородная связь обусловлена тем, что атом водорода, химически связанный в одной молекуле с атомом высокой элктроотрицательностью (например, фтора, кислорода) может соединиться ещё с атомом этого же элемента из другой молекулы. Водородную связь обозначают пунктиром
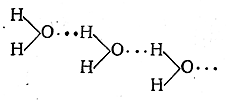
Водородная связь менее прочна чем обычная химическая связь, но оказывает влияние на многие свойства веществ. Различают межмолекулярную водородную связь и внутримолекулярную.
99-118. Укажите тип химической связи в молекулах соединений вашего варианта. Составьте электронные схемы образования молекул с ковалентной связью. Электроны каких орбиталей атомов принимают участие в образовании ковалентной связи? Определите валентность и степени окисления атомов в молекуле. Изобразите электронными уравнениями процессы образования ионов из атомов для соединений с ионной связью.
 2020-10-10
2020-10-10 3461
3461
