Задача 1. Для ухода за кожей рук рекомендуют использовать эмульсионные кремы на основе вазелинового масла, в которых содержится до 14% пчелиного воска, около 35% воды, 1% тетрабората натрия Nа2B4O7 и другие вещества. Для приготовления такого крема используют кристаллогидрат тетрабората натрия. Рассчитайте массу декагидрата тетрабората натрия, который требуется для приготовления 60 г такого крема.
Решение
М(Na2B4O7)=202 г/моль 2 балла
М(Na2B4O7*10H2O)=382 г/моль 2 балла
Масса тетрабората натрия в 60 г крема
m(Na2B4O7)= 0,01 * 60 г = 0,6 г 2 балла
m(соли)/M(соли) = m(кристаллогидрата)/M(кристаллогидрата)
0,6:202=x:382 2 балла
х=1,13 г 2 балла
Всего 10 баллов
Задача 2. Восстановите левую или правую часть уравнений следующих химических реакций
1) … → MnBr2 + Br2 + 2H2O
2) … → 2CaCO3↓ + 2H2O
3) … → 4Fe(OH)3↓ + 4Na2SO4
4) CuS + 4H2O2 → …
5) 6HNO3 + P2O5 → …
Решение
1) MnO2 + 4HBr = MnBr2 + Br2 + 2H2O
2) Ca(OH)2 + Ca(HCO3)2 = 2 CaCO3↓ + 2H2O
3) 4FeSO4 + 8NaOH + O2 + 2H2O = 4Fe(OH)3↓ + 4Na2SO4
4) CuS + 4H2O2 = CuSO4 + 4H2O
5) 6HNO3 + P2O5 = 3N2O5 + 2H3PO4
За каждое уравнение по 2 балла
Всего: 10 баллов
Задача 3. В лаборатории устанавливали состав газообразного органического соединения. Для анализа был взят образец объемом 448 мл (н.у.) и массой 1,16 г. Продукты сгорания этого образца полностью поглотились при последовательном пропускании их через трубку с оксидом фосфора(V) и концентрированным раствором гидроксида калия. Масса трубок увеличилась соответственно на 1,8 г и 3,52 г.
А. Какие выводы исследователи могут сделать на основании анализа результатов исследования?
Б. Какое соединение изучали в лаборатории? Выводы подтвердите соответствующими расчетами.
В. Напишите уравнения всех химических реакций, упомянутых в задаче.
Г. Имеет ли искомое соединение изомеры? Если имеет, то напишите их структурные формулы и назовите по систематической номенклатуре.
Решение
А. На основании анализа результатов исследования можно предположить:
- Соединение органическое, следовательно, в его составе есть углерод, а в продуктах горения есть углекислый газ, поглощаемый в эксперименте щелочью. Масса углекислого газа будет равна приросту массы склянки со щелочью.
- Вторым продуктом реакции горения является вода, так как происходит увеличение массы трубки с оксидом фосфора(V), активно поглощающего воду. Масса воды будет равна приросту массы трубки с оксидом фосфора(V).
- В итоге можно сказать, что в состав искомого соединения входят углерод, водород и, возможно, кислород. Последнее можно доказать с помощью расчетов.
Балла
Б. уравнение реакции горения искомого соединения в общем виде:
448 мл (н.у.); 1,16 г 3,52 г 1,8 г
 CxHy(Oz) + O2 CO2 + H2O
CxHy(Oz) + O2 CO2 + H2O
n(CxHy(Oz)) = 0,448 / 22,4 = 0,02 моль
М(CxHy(Oz)) = 1,16: 0,02 = 58 г/моль
n(CO2) = 3,52 /44 = 0,08 моль
n(H2O) = 1,8 / 18 = 0,10 моль
Расчет количества вещества и массы углерода, водорода, (кислорода) в исходном веществе
n(C) = n(CO2) = 0,08 моль; m(C) = 0,08 × 12 = 0,96 г
n(Н) = n(H2O) × 2 = 0,2 моль; m(Н) = 0,2 × 1 = 0,20 г
m(C) + m(Н) = 0,96 г + 0,20 г = 1,16 г
m(CxHy(Oz)) по условию задачи равна 1,16 г, следовательно, кислорода в исходном соединении нет. Его формулу можно представить так - CxHy
Его формулу можно представить так - CxHy
Нахождение простейшей формулы этого вещества
x: y = n(C): n(Н) = 0,08: 0,20 = 1: 2,5
М(CH2,5) = 14,5 г/моль
M(CxHy) /M(CH2,5) =58/14,5 = 4
Истинная формула искомого соединения C4H10
Балла
В. Уравнение реакции горения бутана
C4H10 + 6,5 O2 = 4 CO2 + 5 H2O
Уравнение реакции взаимодействия углекислого газа со щелочью
2 NaOH + CO2 = Na2CO3 + H2O
Уравнения реакции взаимодействия воды с оксидом фосфора(V)
P2O5 + H2O = 2 HPO3 метафосфорная кислота
P2O5 + 2 H2O = 2 H3PO4 ортофосфорная кислота
P2O5 + 3 H2O = H4P2O7 пирофосфорная кислота
В зависимости от условий образуются разные фосфорные кислоты.
Балла
Г. Бутан имеет два изомера (н-бутан и метилпропан).
Балл
Всего: 10 баллов
Задача 4. Избыток сернистого ангидрида пропустили через раствор перманганата калия. Образовался раствор серной кислоты с концентрацией 4,9 %. Определите концентрацию исходного раствора перманганата.
Решение
Уравнение реакции:
5SO2 + 2KMnO4 + 2H2O = 2MnSO4 + K2SO4 + 2H2SO4 2 балла
ω(KMnO4) = m(KMnO4)/[mр-ра(H2SO4) – m(SO2)]
Пусть mр-ра(H2SO4) = 100 г, тогда
а) m(H2SO4) = 4,9 г; v (H2SO4) = 4,9/98 = 0,05 моль 2 балла
б) по уравнению реакции v (SO2): v (KMnO4): v (H2SO4) = 5:2:2
следовательно, прореагировало 0,02 моль KMnO4 и 0,05 моль SO2 2 балла
в) m(KMnO4) = 0,02·151 = 3,02 г; m(SO2) = 0,05·64 = 3,2 г 2 балла
ω(KMnO4) = 3,02/(100-3,2) = 0,0312 или 3,12 % 2 балла
Итого 10 баллов
Задача 5. В представленной схеме превращений вещество А относится к гомологическому ряду бензола и является монозамещенным производным. Массовая доля углерода в этом углеводороде равна 90,57 %, а его молярная масса не превышает 110 г/моль.
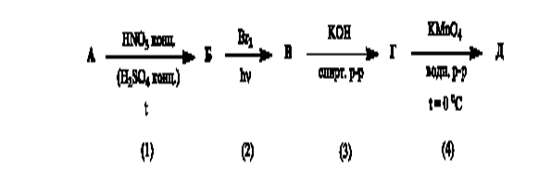
А. Установите структурную формулу вещества А.
Б. Напишите уравнения химических реакций в соответствии со схемой.
В. Назовите вещества А-Е.
Решение
А. Установление формулы вещества А.
Допустим, что масса вещества А равна 100 г. Тогда m(C)= 90,57 г, а m(Н)=9,43 г.
x: y = n(C): n(H) = (90,57/12): (9,43/1) = 7,5475: 9,43 = 1: 1,25
Так как искомое соединение относится к гомологическому ряду бензола, х ≥ 7
Если х =7, то у =8,75, такое соединение не существует.
При х =8, у =10, что соответствует формуле С8Н10. М(С8Н10)=106 г/моль.
Формуле С8Н10 соответствуют 4 соединения: этилбензол или о-, (м-), (п)- ксилолы. Но к условиям заданной цепочки превращений подходит только этилбензол.
Балла
Б.
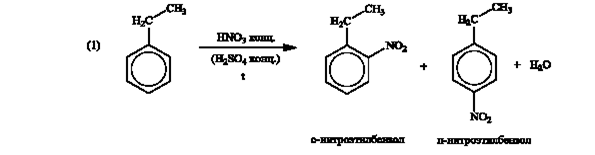
Далее целесообразно продолжать «цепочку» только с одним изомером нитроэтилбензола.
 2020-10-10
2020-10-10 215
215







