По результатам работы рассчитывают значения объема водорода, выделившегося с единицы поверхности каждого образца, и заносят их в таблицу 2.
Объемный показатель коррозии каждого металла с учетом условий испытаний, исходя из количества выделившегося водорода, рассчитывают по формуле:
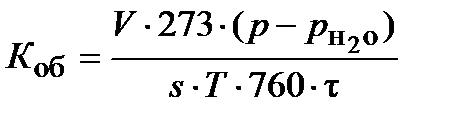 , [см3/(см2∙ч)],
, [см3/(см2∙ч)],
где V – объём водорода, выделившегося за время испытаний, см3; р – атмосферное давление при проведении испытаний, мм рт. ст.;  – давление насыщенного водяного пара при температуре испытаний, мм рт. ст. (см. приложение 4); s – площадь поверхности образца, см2; Т – температура испытаний, К;
– давление насыщенного водяного пара при температуре испытаний, мм рт. ст. (см. приложение 4); s – площадь поверхности образца, см2; Т – температура испытаний, К;  – время испытаний, ч.
– время испытаний, ч.
Массовый показатель коррозии каждого металла рассчитывают по формуле (6). Глубинный показатель коррозии находят по формуле (7), принимая плотность чугуна равной 7,2 г/см3; стали – 7,8 г/см3. Кроме того, коррозионную стойкость исследуемых металлов оценивают по десятибалльной шкале коррозионной стойкости (см. приложение 2).
Результаты работы представляют в виде заполненной таблицы, а также в виде графика кинетики коррозии исследуемых металлов, откладывая по оси ординат удельный объем выделившегося водорода (см3/см2), а по оси абсцисс – время коррозии в минутах. При построении указанных зависимостей все кривые наносят на один график в одинаковом масштабе.
Результаты коррозионных испытаний металлов в 10 %-ной H 2 SO 4
Условия испытаний: атмосферное давление _____ мм Hg; температура _____ оС
Таблица 1
| Металл | Размеры образца, мм | Площадь поверхности образца, см2 | Начальная масса образца, г | Конечная масса образца, г | Объем выделившегося водорода (см3) через мин. | |||||
| 5 | 10 | 15 | 20 | 25 | 30 | |||||
| Сталь | ||||||||||
| Чугун | ||||||||||
Таблица 2
| Металл | Удельный объем выделившегося водорода, см3/см2 через мин. | Показатель коррозии | ||||||||
| 5 | 10 | 15 | 20 | 25 | 30 | Объемный показатель Коб, см3/(см2·ч) | Массовый показатель Км, г/(м2·ч) | Глубинный показатель П, мм/год | Балл коррозионной стойкости | |
| Сталь | ||||||||||
| Чугун | ||||||||||
Лабораторная работа 2
КОРРОЗИЯ МЕТАЛЛОВ
ПРИ ВОССТАНОВЛЕНИИ КИСЛОРОДА
Цель работы
Цель настоящей работы – изучение влияния доступа кислорода к аноду и катоду на силу тока модели коррозионного элемента, работающего при восстановлении кислорода.
Общие положения
Электрохимическая коррозия металлов при восстановлении в катодной реакции растворенного в электролите кислорода – самый распространенный вид коррозии, примерами которой являются ржавление углеродистых сталей и серых чугунов во влажной атмосфере, коррозия нержавеющих сталей и алюминия в морской воде, меди и медных сплавов в нейтральных и кислых средах.
Термодинамическая возможность электрохимической коррозии в данной среде определяется соотношением равновесных потенциалов процесса ионизации металла 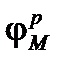 и восстановления окислителя
и восстановления окислителя  (3).
(3).
Тогда самопроизвольное протекание коррозии металлов при восстановлении кислорода возможно при условии:
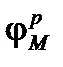 <
< 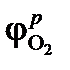 ,
,
где 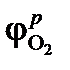 – равновесный потенциал кислородного электрода в данной среде.
– равновесный потенциал кислородного электрода в данной среде.
Коррозия при восстановлении кислорода состоит из анодного процесса (растворение металла):

и катодного процесса (восстановление кислорода), который включает следующие стадии:
- перенос растворенного кислорода в объеме раствора за счет естественной или вынужденной конвекции;
- перенос кислорода внутри диффузионного слоя толщиной δ или внутри слоя продуктов коррозии за счет молекулярной диффузии;
- восстановление кислорода в кислых растворах по реакции
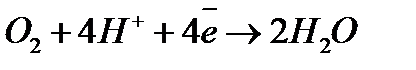 ,
,
в нейтральных и щелочных растворах по реакции
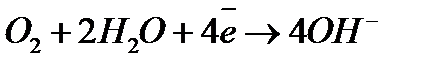 ;
;
- диффузионный и конвективный перенос ионов 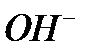 от катодных участков в раствор.
от катодных участков в раствор.
Оба процесса (ионизация металла и восстановление кислорода) протекают одновременно и сопряжено (связанно), но каждый подчиняется свойственным ему закономерностям.
Скорость электрохимической коррозии в большинстве случаев определяется:
- торможением электрохимических стадий электродных реакций (т.е. перехода заряженной частицы через фазовую границу металл-раствор), которое характеризуется электрохимическим перенапряжением (ионизации металла, кислорода и др.);
- транспортными затруднениями, связанными с ограничением подвода окислителя (кислорода) к металлу или отвода продуктов реакции (анодной или катодной) и характеризуемыми обычно перенапряжением диффузии.
В большинстве практических случаев коррозии металлов при восстановлении кислорода (кроме металлов в пассивном состоянии) скорость всего процесса определяется скоростью катодного процесса. В неподвижных растворах скорость катодного процесса лимитируется диффузией кислорода (перенапряжение диффузии), а при больших скоростях движения раствора – восстановлением кислорода (перенапряжение ионизации кислорода).
Перенапряжение ионизации кислорода зависит от природы корродирующего металла (см. приложение 5), температуры, рН раствора и других факторов и описывается уравнением Тафеля
 ,
,
где  – постоянная, зависящая от материала и состояния поверхности, на которой восстанавливается кислород, от состава раствора и температуры;
– постоянная, зависящая от материала и состояния поверхности, на которой восстанавливается кислород, от состава раствора и температуры;  – постоянная, определяемая температурой и механизмом возникновения перенапряжения кислорода на данном материале; i к –плотность катодного тока.
– постоянная, определяемая температурой и механизмом возникновения перенапряжения кислорода на данном материале; i к –плотность катодного тока.
Перенапряжение диффузии кислорода зависит от концентрации кислорода в растворе (см. приложение 6) и условий диффузии его к металлу. Затруднения доставки кислорода к катодным участкам вызваны малой растворимостью и медленной диффузией кислорода в растворах, а также дополнительными ограничениями диффузии в случае образования на поверхности осадков труднорастворимых продуктов коррозии.
Величину перенапряжения диффузии кислорода можно определить по уравнению
 ,
,
где R – газовая постоянная; Т – температура; z – количество электронов, принимающих участие в элементарном акте электродной реакции; F – постоянная Фарадея;  - плотность катодного тока при данных условиях;
- плотность катодного тока при данных условиях; 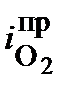 - предельная плотность катодного тока при данных условиях.
- предельная плотность катодного тока при данных условиях.
Предельная плотность катодного тока может быть рассчитана по уравнению
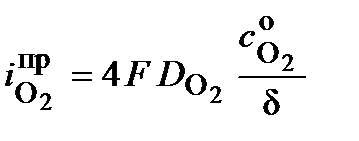 ,
,
где  – коэффициент диффузии кислорода в растворе при данных условиях;
– коэффициент диффузии кислорода в растворе при данных условиях; 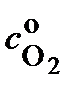 – концентрация кислорода в растворе при данных условиях;
– концентрация кислорода в растворе при данных условиях; 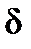 – толщина диффузионного слоя.
– толщина диффузионного слоя.
Повлиять на скорость электрохимического процесса легче всего путем изменения условий, определяющих скорость контролирующей стадии. В частности, при замедленной диффузии кислорода скорость процесса можно повысить за счет уменьшения толщины диффузионного слоя (путем перемешивания раствора), за счет увеличения концентрации растворенного кислорода и в данной модели коррозионного элемента за счет увеличения площади поверхности катода (увеличение фронта диффузии кислорода).
 2020-10-11
2020-10-11 194
194








