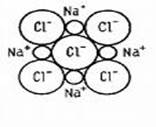
| ‼Такой тип связи характерен для соединений металлов с неметаллами, оксидов металлов, оснований и солей, в том числе солей органических и солей аммония. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака. Ионная связь характеризуется ненаправленностью и ненасыщенностью. Вещества с ионной связью имеют ионную кристаллическую решетку. |
‼ Необходимо помнить, что существуют вещества, в молекуле которых одновременно присутствуют и ионные, и ковалентные связи (например, NaOH, KNO3).
3. Металлическая связь возникает в простых веществах – металлов между положительно заряженными ионами металла и свободно движущимися электронами («электронный газ»). Наличие такого свободного движения электронов является причиной хорошей тепло- и электропроводности металлов.
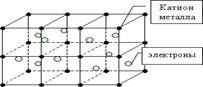
Атомы металлов отличаются от атомов других элементов тем, что сравнительно слабо удерживают свои внешние электроны. Поэтому эти электроны покидают свои атомы, превращая их в положительно заряженные ионы. "Обобществленные" электроны передвигаются в пространстве между катионами металлов и удерживают их вместе.
Водородная связь – это связь не внутри молекулы, а между молекулами или между независимыми частями молекул.
Водородная связь – возникает между сильно электроотрицательными атомами (обычно фтора, кислорода, хлора, азота) и катионами водорода другой молекулы или части молекулы:

(сплошной чертой обозначена ковалентная связь, точками – водородная связь). Водородная связь слабее обычной ковалентной примерно в 10 раз, но многократное её повторение приводит к образованию прочного соединениия
Наличие водородных связей приводят к аномальному повышению температур кипения у веществ, в которых она присутствует.
Температуры кипения водородных соединений неметаллов VIА группы −2 −42 −60
Н2O
tкип, Н2O oС = + 100
Сильные водородные связи между молекулами воды препятствуют ее плавлению и испарению.
Если водородная связь объединяет части одной молекулы, то говорят о внутримолекулярной водородной связи. Это особенно характерно для многих органических соединений, например, для салициловой кислоты.
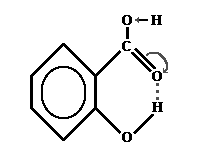

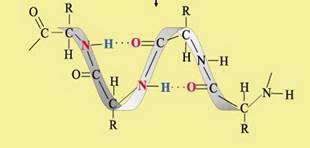
Если же водородная связь образуется между атомом водорода одной молекулы и атомом неметалла другой молекулы (межмолекулярная водородная связь), то молекулы образуют довольно прочные пары, цепочки, кольца.


Уксусная, муравьиная и другие карбоновые кислоты и в жидком, и в газообразном состоянии существуют в виде димеров:

Необходимые для образования водородных связей атомы кислорода и азота содержат все углеводы, белки, нуклеиновые кислоты.

Известно, например, что глюкоза, фруктоза и сахароза прекрасно растворимы в воде. Не последнюю роль в этом играют водородные связи, образующиеся в растворе между молекулами воды и многочисленными OH-группами углеводов.
‼ Вещества, между молекулами которых есть водородные связи:
1. Вода, лёд.
2. Фтороводород, раствор фтороводорода (плавиковая кислота).
3. Растворы аммиака NH3 и аминов – между азотом аммиака (амина) и атомами водорода воды.
4. Органические вещества, имеющие гидроксильную группу: спирты, фенолы, карбоновые кислоты.
5. Растворы углеводов – моносахаридов и дисахаридов.
Белки.
ВАЛЕНТНОСТЬ – число связей, образованных данным атомом в данной молекуле.
Например, в молекуле SO3 у серы 6 связей, т.е. сера в этой молекуле имеет валентность VI.

Валентные возможности атомов – весь набор возможных валентностей.
Они определяются числом неспаренных электронов и возможных донорно-акцепторных связей (ДАС).
Высшая возможная валентность элементов (без учёта ДАС), как правило, равнa номеру группы.
Исключения:
А) азот, кислород, фтор.
Б) элементы VIII группы (в главной подгруппе для гелия, неона и в побочной подгруппе для элементов триад)
В) элементы I группы побочной подгруппы – медь, серебро, золото (у них высшая валентность больше номера группы).
Степень окисления – гипотетический заряд у атома в молекуле, рассчитанный, исходя из предположения об ионном характере всех связей и из того, что в целом молекула электронейтральна.
Пример: +1 +6 -2
K2 Cr2 O7 (+1) ∙2 + (+6) ∙2 + (-2) ∙7 = 0
 2020-10-11
2020-10-11 365
365








