Теория для ПЗ №3
Химические частицы, образованные из двух или нескольких атомов, называются молекулами (реальными или условными формульными единицами многоатомных веществ). Атомы в молекулах химически связаны. Под химической связью понимают электрические силы притяжения, удерживающие частицы друг около друга. Каждая химическая связь в структурных формулах представляется валентной чертой, например: H – H (связь между двумя атомами водорода); H3N – Н+ (связь между атомом азота молекулы аммиака и катионом водорода); (К+) – (I-) (связь между катионом калия и иодид-ионом). Химическая связь образуется парой электронов (•), которая в электронных формулах сложных частиц (молекул, сложных ионов) обычно заменяется валентной чертой, в отличие от собственных, неподеленных электронных пар атомов, например: Ковалентная связь – связь между двумя атомами- неметаллами, которые соединяются друг с другом за счет образования ОБЩЕЙ электронной пары.
Существует два возможных механизма образования общей электронной пары:
· обменный механизм, когда каждый из взаимодействующих атомов предоставляет в пару по одному электрону,
· донорно-акцепторный механизм, если один из атомов предоставляет электронную ПАРУ, а другой – пустую (вакантную) орбиталь.
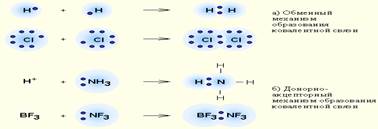
‼ По донорно-акцепторному механизму образованы связи в следующих веществах:
1. Все комплексные соединения, например: K3[Al(OH)6]
2. Соли аммония и аминов: NH4Cl и т.п.
Азотная кислота, нитраты.
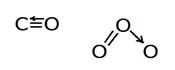
4. Газы СО- угарный газ, О3 – озон.
| 
|
Электроотрицательность (ЭО) – способность атома притягивать электроны при образовании химической связи. Таким образом, электрон сместится к атому того элемента, который имеет большую электроотрицательность.
Возможно три случая для двух атомов А и В, образующих связь: А - В
1) ЭО (А) = ЭО(В) (разность электроотрицательностей равна нулю).
Общая электронная пара не смещена ни к одному из атомов. Не возникает ПОЛЮСОВ, электронная плотность у обоих атомов одинакова.Это НЕПОЛЯРНАЯ ковалентная связь.
‼Примеры неполярной ковалентной связи: а) двухатомные простые вещества: H–H, F–F,
б) симметричные молекулы типа Н2О2 (Н-О-О-Н) – связь между двумя атомами кислорода и т.п.
2) ЭО (А) > ЭО(В). При образовании ковалентной связи электронная пара смещена к более электроотрицательному атому А, на нём возникает частичный отрицательный заряд, а на В – частичный положительный.Такая связь называется ковалентной ПОЛЯРНОЙ.
‼ Такой тип связи характерен для молекул (или частей молекул), состоящих из двух и более неметаллов (HCl, H2O, СН3СООН).
Чем больше разность ЭО, тем выше полярность связи (при этом электронная пара принадлежит обоим атомам). Например, в ряду НСl à HBr à HI полярность связи уменьшается.
3) ЭО (А) >> ЭО(В). Разность электроотрицательностей настолько велика, что атом В (металл) ОТДАЁТ свой электрон атому А (неметалл). Возникают ИОНЫ - катион В + и анион А -.
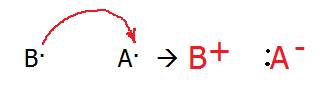
Такая связь называется ИОННОЙ.
 2020-10-11
2020-10-11 253
253







