Обычно достигаемый в лабораториях вакуум («пустота»), при котором столкновения молекул между собой уже сравнительно редки, соответствует давлению примерно в 0,13 Па. При каком вакууме в каждом кубическом сантиметре разреженного газа остается еще около 3·1013 частиц. Даже с помощью самых совершенных методов современной техники не удается достигнуть вакуума, при котором в кубическом сантиметре газа оставалось бы менее 1000 частиц. Между тем кубический сантиметр межпланетного пространства содержит лишь десятки частиц, а межзвездного — еще гораздо меньше. Именно поэтому «межзвездное пространство одновременно и исключительно холодно и чрезвычайно горячо» (Эддингтон).
Фактическая температура находящегося в межпланетном пространстве тела соответствует средней энергии движения его собственных частиц. Она определяется в основном лучепоглощением и лучеиспусканием этого тела. Например, обращенная к Солнцу сторона Луны (на ее экваторе) нагревается до +120 °С, а обратная осаждается до -150 °С. Так как одни поверхности (особенно-зеркальная) сильно затрудняют обмен лучистой энергией, а другие (особенно — шероховатая черная) такому обмену очень способствуют, путем изменения характера направленных к Солнцу и от него поверхностей находящегося в межпланетном пространстве тела можно регулировать его температуру.
Масса литра воздуха при нормальных условиях (1,293 г), а его средняя молярная масса воздуха равна 22,4·1,293 = 29 г/моль.
Пример 1. Вычислим плотность хлора по отношению к воздуху. Молекулярная формула хлора — Cl2, молярная масса — 35,5·2 = 71. Как вытекает из закона Авогадро, данный газ во столько раз тяжелее (легче) воздуха, во сколько раз его молярная масса больше (меньше) средней молярной массы воздуха. Следовательно, плотность хлора по отношению к воздуху будет 71:29 = 2,45, т. е. хлор приблизительно в 2,5 раза тяжелее воздуха.
При достаточном охлаждении воздух переходит в жидкое состояние. Жидкий воздух можно довольно долго сохранять в сосудах с двойными стенками, из пространства между которыми для уменьшения теплопередачи выкачан воздух. Подобные сосуды используются, например, в термосах.
Свободно испаряющийся при обычных условиях жидкий воздух имеет температуру около -190 °С. Состав его непостоянен, так как азот улетучивается быстрее кислорода. По мере удаления азота цвет жидкого воздуха изменяется от голубоватого до бледно-синего (цвет жидкого кислорода).
До XIX века считали, что газы являются таковыми по самой своей природе, и вопрос о их сжижении даже не возникал. Лишь в 20-х годах XIX века, применяя значительные давления, удалось получить в жидком состоянии хлор, аммиак, диоксид углерода и ряд других веществ «газообразной природы». Однако оставались еще многие, в частности основные газы воздуха — кислород и азот, которые, несмотря на все усилия, не сжижались. На них перенесли то представление, которое раньше было общим и стали считать их «постоянными» газами. Только в 1877 г. впервые удалось получить в жидком состоянии один из этих «постоянных» газов — кислород. Вслед за тем были сжижены и все другие.
Причина неудач ранних попыток сжижения газов лежала в том, что еще неясна была сущность различия между газообразным и жидким состоянием вещества. В обоих случаях имеет место и взаимное притяжение молекул, и их взаимное расталкивание. Жидкое состояние вещества характеризуется преобладанием первого, газообразное — второго. Взаимное притяжение молекул практически не зависит от температуры. Напротив, обусловленное их ударами друг о друга взаимное расталкивание, весьма сильно зависит от температуры, так как ее величина определяет скорость движения молекул и их кинетическую энергию. Газ может быть переведен в жидкое состояние лишь тогда, когда стяжение получает преобладание над расталкиванием или по крайней мере становится равным ему. Та температура, при которой расталкивание уравновешивается стяжением, характеризуется отсутствием различия между жидкостью и ее паром и называется критической. Существование такой температуры было впервые установлено Д. И. Менделеевым (1861 г.).
Критическая температура различна для разных веществ и, например, для хлора равна +144 °С. Поэтому, применив достаточное давление, хлор можно перевести в жидкое состояние и без его охлаждения. Критические температуры основных газов воздуха лежат, наоборот, очень низко: кислорода при -118 °С и азота при -147 °С. Поэтому воздух можно перевести в жидкое состояние, лишь охладив его предварительно ниже указанных температур. Между тем исследователи раннего периода пытались получить жидкий воздух, применяя высокие давления, но не заботясь о достаточном охлаждении.
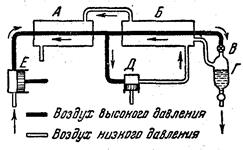
Рис. 3.2. Принципиальная схема установки для получения жидкого воздуха.
Трудно сжижаемые газы научились сжижать используя их свойства охлаждаться при расширении, если газ многократно сжимать и выпускать его в большой сосуд, то он будет охлаждаться и когда его температура достигнет критической он начнет сжижаться.
Принципиальная схема установки для получения жидкого воздуха показана на рис. 3.2. Предварительно освобожденный от пыли, влаги и углекислого газа воздух сжимается компрессором (Е) до 2·107-2,5·107 атм. (при одновременном охлаждении водой), проходит первый теплообменник (А) и затем разделяется на два потока. Большая часть направляется в детандер (Д) — поршневую машину, работающую за счет расширения воздуха. Последний, значительно охладившись в детандере, омывает оба теплообменника и, охладив текущий навстречу сжатый воздух, покидает установку. Другой поток сжатого воздуха, охлажденный еще более во втором теплообменнике (Б). направляется через вентиль (В) в расширительную камеру (Г), после чего покидает установку вместе с воздухом из детандера. Вскоре наступает момент, когда в расширительной камере достигается температура сжижения воздуха, а затем он уже непрерывно получается в жидком состоянии.
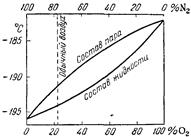
Рис. 3.3. Температура кипения и состав жидкого воздуха.
В 1938 г. П. Л. Капицей был разработан метод получения жидкого воздуха при низком давлении — всего 5-6 атм. Основной особенностью этого метода является замена поршневых механизмов компрессора и детандера турбинными.
Наиболее простое экспериментальное определение критической температуры жидкостей производят следующим образом. В толстостенной стеклянной трубке запаивают небольшое количество исследуемого вещества. На границе раздела жидкости и ее пара образуется мениск. При постепенном нагревании трубки в ней все время увеличивается давление, а потому жидкость целиком не испаряется, и мениск отчетливо виден. Вблизи критической температуры он становится все более плоским и, наконец, исчезает. Та температура, при которой происходит исчезновение мениска (т. е. поверхности раздела двух фаз), и является критической температурой исследуемого вещества.
В жидкости относительно преобладает кислород, в паре — азот. Например, при -190 °С жидкость содержит около 60% кислорода, пар — только 30%. Этим и обусловлено то обстоятельство, что по мере испарения воздуха жидкость обогащается кислородом, причем температура ее кипения постепенно повышается. Одновременно возрастает и плотность жидкого воздуха (приблизительно 0,94 г/см3 для нормального состава). Температура его затвердевания также зависит от состава, причем наинизшая она (-223 °С) при содержании 78% кислорода.

Рис. 3.4. Схема работы тарелок разделительной колонны.
Отделение друг от друга жидкостей с близкими температурами кипения осуществляется обычно в разделительных колоннах. Основной задачей такой колонны является создание потока пара (П), направленного вверх, и потока жидкости, стекающей вниз (рис. 3.4). Для обоих потоков при помощи специальных приспособлений — «тарелок» — обеспечиваются условия наиболее тесного соприкосновения, что ведет к постоянному обмену молекулами. При этом у вещества с более низкой точкой кипения (например, азота) молекулы чаще попадают в поток пара, а с более высокой (например, кислорода) — в поток жидкости. Колонна работает непрерывно и тем полнее разделяет оба вещества, чем больше в ней «тарелок». Общая схема колонны для разделения воздуха показана на рис. 3.5.
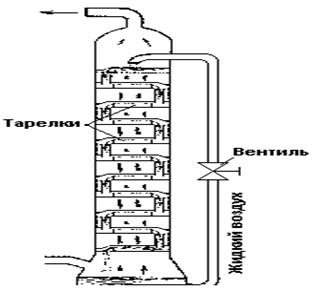
Рис. 3.5. Общая схема колонны для разделения воздуха.
Сжатый воздух хранят в стальных баллонах, рассчитанных на давление 150 атм. По действующим техническим условиям баллоны эти должны иметь черную окраску с белой надписью: «Воздух сжатый».
При температурах жидкого воздуха свойства многих веществ резко изменяются. Например, жёлтая при обычных условиях сера становится белой. Такие жидкости и газы, как спирт, диоксид углерода и т. п., при соприкосновении с жидким воздухом затвердевают. Свинцовая пластинка после погружения в жидкий воздух издаёт при ударе ясный металлический звон, резина становится настолько хрупкой, что при ударе разбивается на куски, и т. д.
Химические реакции при температуре жидкого воздуха вообще очень сильно замедляются. Однако благодаря большой концентрации в нём кислорода (концентрацией называется количество вещества в единице объёма или массы), смешанные с жидким воздухом горючие вещества горят гораздо энергичнее, чем в обычных условиях. Например, смоченная жидким воздухом вата сгорает со вспышкой подобно бездымному пороху.
На этом основано применение жидкого воздуха для взрывных работ в горном деле, где используются патроны с пропитанными им горючими материалами. Подобное взрывчатое вещество (оксиликвит) по силе взрыва лишь немногим уступает динамиту, при этом оно дешевле и безопасней в обращении. Ещё эффективнее оксиликвиты на основе жидкого кислорода, которые изготовляются пропитыванием органических поглотителей (древесных опилок, углей) жидким кислородом.
 2020-10-11
2020-10-11 191
191








